Cibo non digerito e infiammazione intestinale I parte (aggiornamento 24-02-2026)
Note riassuntive punti salienti delle ricerche sull’argomento trattato
Premessa – Il percorso del cibo (cenni)
Il cibo ingerito inizia il suo percorso nella bocca, dove comincia la digestione degli amidi grazie all’azione dell’amilasi salivare. Prosegue nello stomaco, dove le proteine vengono scomposte in peptidi più piccoli per effetto dell’acido cloridrico e della pepsina. Successivamente passa nell’intestino tenue, dove enzimi digestivi pancreatici e intestinali completano la digestione di amidi, proteine e grassi. L’assorbimento dei nutrienti avviene principalmente nell’intestino tenue attraverso i villi intestinali, estroflessioni della mucosa che aumentano enormemente la superficie assorbente. I nutrienti che attraversano i villi entrano nel circolo sanguigno. Solo le molecole completamente digerite possono attraversare in modo corretto la barriera intestinale.
Il materiale non digerito passa nel colon, la cui funzione principale è:
-
riassorbire acqua ed elettroliti
-
fermentare i residui alimentari tramite il microbiota
-
formare le feci per l’eliminazione
In condizioni fisiologiche, il contenuto non digerito viene eliminato senza attraversare la barriera intestinale.
8.1 La barriera fisica intestinale
Dal lume intestinale all’ambiente interno dell’organismo, la barriera fisica è costituita da:
-
uno strato (intestino tenue) o due strati (intestino crasso) di muco
-
un singolo strato di cellule epiteliali
-
l’endotelio vascolare
Le cellule epiteliali rappresentano la vera barriera selettiva contro molecole prive di sistemi di trasporto specifici e contro cellule microbiche presenti nel lume.
Le cellule epiteliali sono strettamente connesse tramite proteine di membrana:
-
Occludina e claudine → giunzioni strette (tight junctions, TJ)
-
Desmosomi e giunzioni aderenti (AJ) → stabilità strutturale
La barriera intestinale è una struttura dinamica, non statica. Le giunzioni strette possono aprirsi o chiudersi in risposta a stimoli interni o esterni.
Un regolatore fondamentale dell’integrità della barriera è la zonulina. In presenza di un aumento dei microbi nell’intestino tenue, l’attivazione della zonulina determina l’apertura transitoria delle giunzioni strette, consentendo il passaggio di acqua per facilitare la rimozione dei microbi e supportare le reazioni idrolitiche della digestione.
Nota
[1]-L’endotelio vascolare è uno strato di cellule endoteliali che riveste la superficie interna dei vasi sanguigni, dei vasi linfatici e del cuore. Svolge un ruolo cruciale nella regolazione del flusso sanguigno, nella prevenzione della formazione di coaguli e nella comunicazione tra i vasi e i tessuti circostanti.
8.3 Perché la barriera intestinale è necessaria
La barriera intestinale deve essere impermeabile soprattutto alle molecole alimentari non completamente digerite. La disseminazione microbica deve essere evitata, ma la funzione primaria della barriera è impedire il passaggio di molecole alimentari non adeguatamente degradate.
La rottura della barriera consente la fuoriuscita di:
-
microbi e loro componenti
-
molecole alimentari non digerite
-
cellule e mediatori immunitari
Tutti questi elementi possono innescare una risposta infiammatoria sistemica.
La compromissione della barriera deve quindi essere evitata.
9. Impatto delle abitudini alimentari sull’integrità della barriera intestinale
Oggi è sempre più chiaro che la barriera intestinale deve rimanere integra per evitare malattie autoimmuni [35]. È quindi importante evitare o limitare alimenti e farmaci che possono compromettere l’integrità della barriera intestinale, incluse situazioni di stress persistente, e preferire fattori alimentari che possano rafforzarne l’integrità [28].
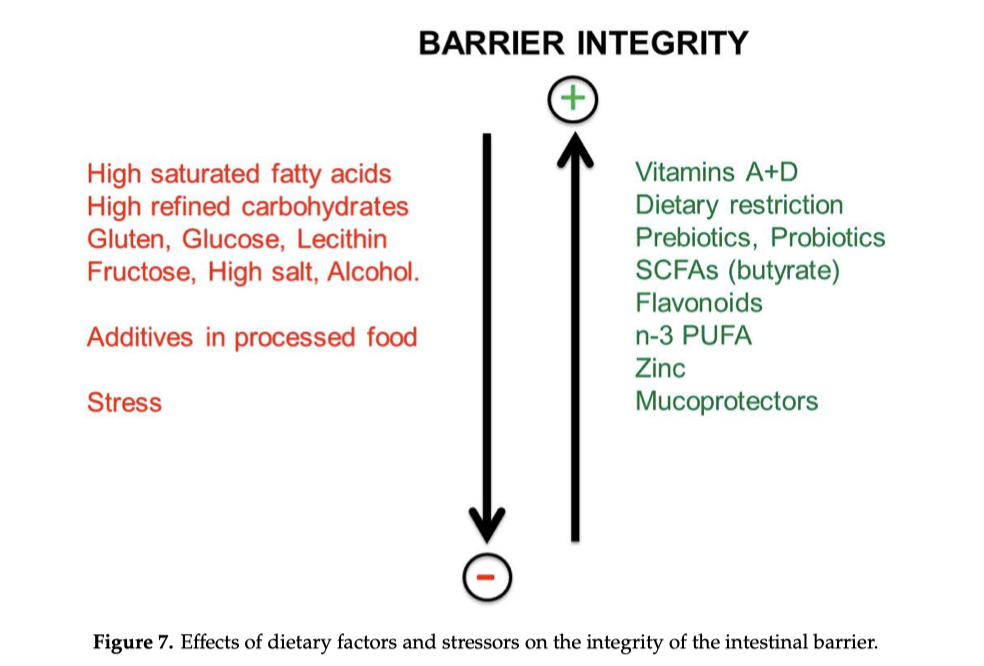
Come mostrato nella Figura 7, i seguenti elementi riducono l’integrità delle giunzioni strette (tight junctions) e aumentano la permeabilità della barriera intestinale: diete occidentali, acidi grassi saturi, glutine, sale, alcol e additivi chimici presenti negli alimenti trasformati. I “fattori che alterano la barriera intestinale” agiscono direttamente oppure attraverso la modulazione della composizione del microbiota intestinale. Anche i farmaci antinfiammatori non steroidei e lo stress possono danneggiare il tratto gastrointestinale. Lo stress provoca un deterioramento della barriera tramite l’attivazione dell’asse del fattore di rilascio della corticotropina (CRF) e dei mastociti.
Al contrario, i seguenti fattori esercitano un effetto protettivo sulla barriera: restrizione calorica o digiuno, prebiotici, probiotici, butirrato (SCFA, acidi grassi a catena corta), vitamine D e A, flavonoidi, PUFA omega-3, zinco, mucoprotettori (gelatina tannato e probiotici tindalizzati).
10. Fattori che aumentano la permeabilità della barriera intestinale
10.1 Glutine
Oggigiorno è noto che il glutine può esercitare un’azione diretta sulla barriera mucosale intestinale [36]. In particolare, la frazione gliadina è in grado di attivare la proteina zonulina [30], un modulatore fisiologico delle giunzioni strette (tight junctions). L’attivazione della zonulina può determinare un allentamento delle giunzioni intercellulari e un aumento della permeabilità intestinale.
È ormai accettato che la risposta anticorpale osservata da Reichelt e Jensen [34] fosse correlata al passaggio di frammenti di gliadina attraverso la barriera intestinale, intatti o solo parzialmente digeriti. L’aumentata permeabilità indotta dal glutine risulta particolarmente documentata nel contesto della celiachia e, in misura variabile, in alcuni sottogruppi di soggetti con sensibilità al glutine non celiaca (NCGS) [36].
Il glutine è una rete proteica che si forma in presenza di acqua a partire da gliadina e glutenina, proteine presenti in grano, segale e orzo. È quindi contenuto in alimenti quali pane, pasta, pizza, prodotti da forno e birra, ed è frequentemente aggiunto anche a prodotti trasformati [37]. Il glutine presenta una certa resistenza alla digestione enzimatica; frammenti parzialmente digeriti possono persistere nel lume intestinale. Secondo alcune ipotesi, tali frammenti potrebbero essere riconosciuti dal sistema immunitario come molecole microbiche (mimetismo molecolare), in alcuni casi con somiglianza strutturale a proteine virali, come quelle dell’adenovirus [38]. Questo meccanismo è stato proposto come possibile stimolo per il rilascio di zonulina e la modulazione delle giunzioni strette.
Alcuni autori hanno inoltre ipotizzato che, in presenza di aumentata permeabilità intestinale e attivazione immunitaria sistemica, possano verificarsi alterazioni anche della barriera emato-encefalica (BBB), anch’essa costituita da giunzioni strette. I frammenti di glutine o gli anticorpi anti-gliadina potrebbero teoricamente contribuire a fenomeni di reattività crociata con proteine cerebrali. Sono stati descritti anticorpi anti-gliadina in associazione con alcune condizioni neurologiche, suggerendo un possibile coinvolgimento dell’asse intestino-cervello [39,40].
⚠ Nota critica metodologica
Pur non esistendo prove cliniche definitive che dimostrino che il glutine causi direttamente un aumento della permeabilità intestinale nei soggetti sani o induca danni strutturali alla barriera emato-encefalica con conseguente neurodegenerazione, la letteratura scientifica include numerosi studi sperimentali, osservazionali e revisioni che hanno esplorato ed evidenziato tali meccanismi. Le evidenze risultano più solide nel contesto della celiachia e nei soggetti con sensibilità al glutine non celiaca (sottogruppi non tutti). È tuttavia necessario precisare che per “soggetto sano” non si intende semplicemente un individuo privo di malattie clinicamente manifeste, ma una persona senza patologie in atto e senza uno stato di infiammazione cronica di basso grado.
Inoltre, in letteratura sono stati evidenziati limiti metodologici nella misurazione della zonulina mediante alcuni kit ELISA commerciali; pertanto, il termine “zonulina” deve essere interpretato con cautela come biomarcatore diretto di permeabilità intestinale.
Sintesi concettuale
-
Il glutine (in particolare la gliadina) può attivare la zonulina.
-
L’attivazione della zonulina può modulare le giunzioni strette e aumentare la permeabilità intestinale.
-
Frammenti parzialmente digeriti possono stimolare il sistema immunitario.
-
È stata ipotizzata una possibile reattività crociata con proteine cerebrali.
-
L’associazione tra glutine, permeabilità intestinale, BBB e neurodegenerazione è oggetto di studio, ma non supportata da prove cliniche definitive nei soggetti sani.
Articoli scientifici e review
-
Philip A. (2022) – Gluten, Inflammation, and Neurodegeneration
– Questo lavoro di revisione discute una possibile relazione tra l’assunzione di glutine, infiammazione cronica, disbiosi intestinale e condizioni neurologiche correlate, e valuta evidenze osservazionali e meccanismi proposti.
• DOI: 10.1177/15598276211049345 (Online Abstract) (SAGE Journals)
• PMCID: PMC8848113, PMID: 35185424 (versione PubMed Central) (PMC) -
Mohan et al. (2020) – Dietary Gluten and Neurodegeneration: A Case for…
– Suggerisce che infiammazione intestinale indotta dal glutine e disbiosi possono compromettere la biologia intestino-cervello e avere potenziali implicazioni per neuroinfiammazione e neurodegenerazione, pur non affermando causalità clinica definitiva.
• MDPI International Journal of Molecular Sciences (2020), citato da 27 lavori (MDPI) -
Obrenovich M.E.M. et al. (2018) – Leaky Gut, Leaky Brain?
– Mini-review che esplora il concetto ipotetico di “leaky gut” e “leaky brain”, il ruolo del microbiota e di condizioni infiammatorie croniche (come la celiachia) nella compromissione della barriere intestinali e del BBB.
– PubMed Central (PMC) review (PMC) -
Daulatzai et al. (anno non specificato) – Non-celiac gluten sensitivity triggers gut dysbiosis, neuroinflammation, gut-brain axis dysfunction, and vulnerability for dementia
– Uno studio focalizzato sui potenziali effetti della sensibilità al glutine (NCGS) su disbiosi intestinale, neuroinfiammazione e vulnerabilità verso disfunzioni neurologiche. Anche qui si tratta di un modello proposto, non di un’evidenza clinica conclamata. (Semantic Scholar)
Concetti biologici chiave supportati dalla letteratura
✔️ Zonulina e permeabilità intestinale – La zonulina è una proteina regolatrice dei “tight junctions” della mucosa intestinale che può essere attivata dalla gliadina (frazione del glutine) nei soggetti predisposti (soprattutto nella celiachia), con aumento della permeabilità.
✔️ Asse gut-brain – Numerosi studi (come quello di Obrenovich) citano il microbiota e l’infiammazione cronica come possibili mediatori tra intestino e funzione del BBB, anche se negli esseri umani la dimostrazione diretta resta preliminare. (PMC)
In sintesi:
Il glutine attiva la zonulina, che allenta le giunzioni strette aumentando la permeabilità intestinale. Frammenti di glutine parzialmente digeriti possono attraversare la barriera e stimolare una risposta immunitaria.
Il glutine:
-
è resistente alla digestione
-
può mimare proteine microbiche (mimetismo molecolare)
-
può indurre reazioni crociate con proteine cerebrali
L’apertura della barriera intestinale può associarsi a un aumento della permeabilità della barriera emato-encefalica.
“In letteratura esistono limiti metodologici nella misura della zonulina con alcuni ELISA commerciali; quindi ‘zonulina’ va interpretata con cautela come biomarcatore di permeabilità.”
10.2 Alcol
L’assunzione cronica di alcol favorisce la proliferazione batterica e la disbiosi intestinale [41]. Altera inoltre l’integrità della barriera intestinale riducendo i livelli della molecola antimicrobica REG3, favorendo così l’accesso microbico alla mucosa intestinale [42]. Inoltre, l’alcol interferisce con il metabolismo degli acidi grassi, delle proteine e dei carboidrati, convertendo il NAD+ in NADH che è una molecola pro-infiammatoria.
In sintesi l’assunzione cronica di alcol:
-
favorisce disbiosi
-
riduce REG3 (molecola antimicrobica)
-
aumenta l’accesso microbico alla mucosa
-
altera il metabolismo cellulare (aumento NADH)
-
promuove infiammazione sistemica
10.3 Additivi degli alimenti trasformati
Gli alimenti trasformati possono contenere diverse sostanze chimiche aggiunte per migliorarne la stabilità nel tempo e l’appeal per il consumatore. Gli additivi possono essere conservanti, aromi artificiali, coloranti, emulsionanti, dolcificanti artificiali e/o antibiotici. Tutti possono alterare il microbiota intestinale umano [35,43–46]. Ad esempio, gli emulsionanti alimentari possono ridurre la diversità del microbiota intestinale, possono favorire l’infiammazione e ridurre lo spessore dello strato di muco. I dolcificanti non nutritivi (stevia, aspartame e saccarina)possono avere un effetto batteriostatico (rallenta o blocca la moltiplicazione batterica “buona”) sul microbiota intestinale. Anche l’assunzione di antibiotici, che può essere presente negli alimenti trasformati, riduce la diversità microbica, ma può anche causare resistenza agli antibiotici. Un problema importante è l’aggiunta agli alimenti trasformati di componenti provenienti da altri alimenti, come lattosio, zucchero, proteine del siero del latte, glutine, lattosio e caseina. Questi ingredienti aggiunti possono rappresentare un sovraccarico di determinati alimenti e causare intolleranze.
Note
Microbiota: rappresenta l’insieme di tutti i singoli microrganismi -dai batteri, ai funghi, ai protozoi fino ai virus- che convivono con il nostro organismo senza danneggiarlo. Microbioma: ci si riferisce al patrimonio genetico del microbiota, cioè a tutto il DNA e RNA dei microrganismi.
10.4 Disbiosi e permeabilità
Ciò che può danneggiare l’integrità della barriera intestinale è innanzitutto la disbiosi intestinale spesso associata a una riduzione della biodiversità microbica e a modificazioni funzionali del microbiota (alterazioni nella produzione di SCFA, LPS, acidi biliari). Può avere un ruolo anche l’aumento del rapporto Firmicutes/Bacteroidetes e alla diminuzione della diversità microbica complessiva [19,20]. Firmicutes e Bacteroidetes sono i “tipi” batterici più rappresentati nell’intestino. Una disbiosi persistente porta a un aumento del rapporto Th17/Treg (vedi approfondimento B) e del lipopolisaccaride LPS, innescando l’infiammazione intestinale. Di conseguenza, le giunzioni strette si allentano e la barriera si apre. Ciò che si trova nel lume (intestino) fuoriesce ed entra nel flusso sanguigno: in particolare frammenti di cibo non digerito; microbi, citochine pro-infiammatorie come l’interleuchina 6; e endotossine come LPS, un’endotossina che è un marcatore della traslocazione di batteri gram-negativi [47,48]. Di conseguenza, si sviluppano endotossiemia sistemica, infiammazione sistemica cronica e malattie infiammatorie croniche. Poiché la disbiosi intestinale dipende principalmente dalle nostre abitudini alimentari e dal nostro stile di vita, può contribuire (molto) a causare l’infiammazione intestinale, l’apertura della barriera intestinale e le malattie metaboliche e croniche del nostro tempo*. Tra queste è possibile associare alla disbiosi intestinale lo sviluppo di malattie neurodegenerative, che hanno una base infiammatoria.
È importante sottolineare che la relazione tra disbiosi, permeabilità e malattia è bidirezionale e multifattoriale: dieta, genetica, farmaci (es. antibiotici, FANS), infezioni, età e condizioni metaboliche possono sia influenzare il microbiota sia esserne influenzate. Pertanto, la direzione causa-effetto (malattia ↔ dieta ↔ microbiota ↔ infiammazione) rimane complessa e non univocamente dimostrata in molte condizioni cliniche.
Numerosi studi hanno inoltre esplorato il possibile coinvolgimento dell’asse intestino-cervello nello sviluppo di patologie neurodegenerative a base infiammatoria; tuttavia, anche in questo ambito le evidenze nell’uomo restano prevalentemente associative o derivate da modelli sperimentali.
In sintesi la disbiosi è spesso associata a:
-
aumento rapporto Firmicutes/Bacteroidetes
-
riduzione biodiversità
-
aumento Th17/Treg
-
aumento LPS
Conseguenze:
-
infiammazione intestinale
-
allentamento giunzioni strette
-
traslocazione di microbi, LPS, citochine e frammenti alimentari
-
endotossiemia sistemica
-
infiammazione cronica
1. Infiammazione intestinale cronica
L’infiammazione è un processo di difesa innato e non specifico [2,3]. Si verifica in risposta alla presenza di materiale estraneo (non-self), o come conseguenza di danni tissutali causati da agenti fisici, chimici o biologici, o da anomalie come l’incapacità di eliminare le scorie o di digerire i nutrienti. Se la causa dell’infiammazione persiste, anche l’infiammazione persiste, solitamente con bassa intensità, e viene chiamata infiammazione cronica di basso grado.
2 – Il cibo è soggetto attivo
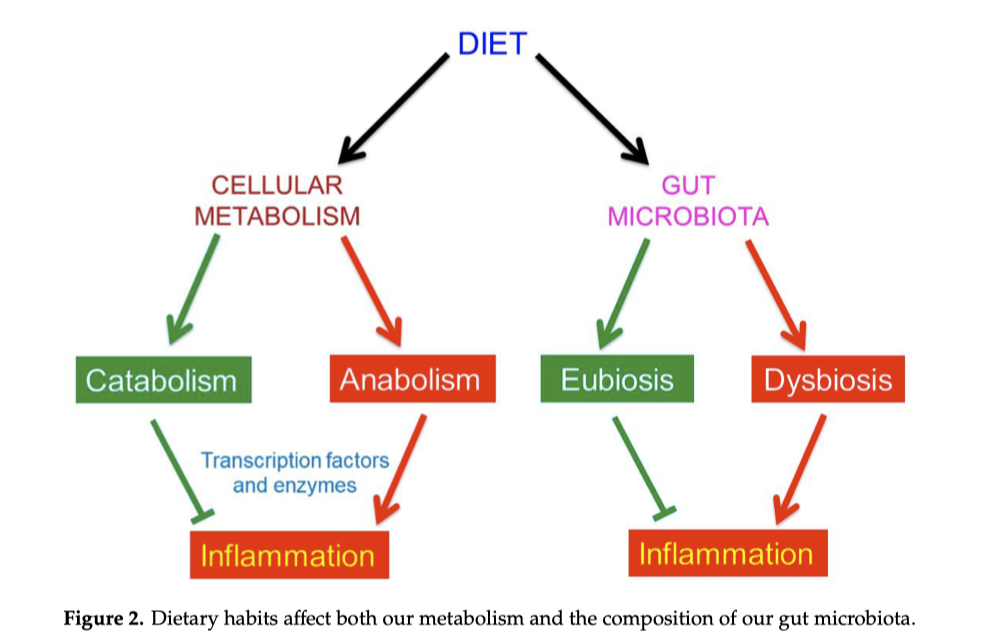
Fondamentalmente, il cibo può influenzare il nostro stato di salute in due modi: (1) intervenendo sulla barriera intestinale e quindi contribuendo alla rottura della barriera emato-encefalica e al metabolismo, e/o (2) condizionando la composizione del nostro microbiota intestinale (Figura 2). L’azione delle nostre abitudini alimentari sia sul metabolismo che sul microbiota intestinale può prevenire o diminuira l’infiammazione cronica. Come vedremo l’infiammazione cronica è correlata a varie malattie croniche del nostro tempo, comprese quelle neurodegenerative.
3 – Gli effetti del cibo sul microbiota intestinale umano
Il microbiota intestinale dipende da noi per il suo sostentamento; infatti, il cibo che scegliamo di mangiare determina la composizione del microbiota intestinale, nutrendo una o l’altra popolazione microbica e favorendone così la crescita [21–24].
Per spiegare come l’assunzione di cibo determini la composizione del nostro microbiota intestinale, per semplicità possiamo ridurre le nostre abitudini alimentari a due soli tipi di dieta: (1) la dieta vegetariana [VD], che è una dieta ipocalorica e ricca di fibre; e (2) la dieta “occidentale” [WD], che è una dieta ipercalorica, prevalentemente carnivora, ricca di acidi grassi saturi e carboidrati raffinati, e spesso associata ad alimenti trasformati industrialmente [25]. La [VD] è adatta solo a quelle popolazioni microbiche intestinali in grado di digerire i carboidrati complessi delle fibre, che non possiamo degradare. Le fibre rappresentano il carburante ideale per i batteri appartenenti al tipo Bacteroidetes, come la Prevotella. In cambio, producono molecole utili, come gli SCFA, in particolare il butirrato [26].
I batteri [VD] sono associati all’eubiosi intestinale, all’elevata biodiversità, all’integrità della barriera intestinale e alla salute umana. Il caso della dieta occidentale, povera di fibre, è ovviamente diverso. La dieta occidentale è preferita dalle popolazioni microbiche che non possiedono i meccanismi per la digestione dei carboidrati complessi presenti nelle fibre. L’alimentazione dei batteri [WD], più adatti a raccogliere l’energia assunta in eccesso con la dieta occidentale, porta alla produzione di acidi biliari, tossici per molti batteri [VD]. Pertanto, la relazione reciproca tra le diverse popolazioni microbiche viene persa. Il risultato è una significativa diminuzione della biodiversità del microbiota e uno stato disbiotico che se persiste nel tempo è la premessa per l’infiammazione intestinale. Per evitare la disbiosi e l’infiammazione intestinale, è opportuno preferire una dieta prevalentemente vegetariana. È opportuno sottolineare a questo punto che in condizioni di salute il cibo interagisce con il microbiota intestinale anche se non è completamente digerito, mentre i suoi effetti sul metabolismo si verificano solo attraverso le molecole completamente digerite, dopo l’assorbimento e quindi al di fuori dell’intestino.
In sintesi:
Dieta vegetariana (VD)
-
ricca di fibre
-
favorisce Bacteroidetes (es. Prevotella)
-
produce SCFA (butirrato)
-
favorisce eubiosi
Dieta occidentale (WD)
-
ricca di grassi saturi e zuccheri raffinati
-
povera di fibre
-
riduce biodiversità
-
favorisce disbiosi
Una disbiosi persistente è premessa per l’infiammazione intestinale.
4. Il microbiota intestinale
L’intestino umano è colonizzato da un numero enorme di microbi diversi: batteri, virus e funghi che costituiscono nel loro insieme il microbiota intestinale.
Ognuno di noi ha il proprio microbiota, diverso da tutti gli altri come un’impronta digitale [15–17], una diversità che deriva da fattori quali il genotipo dell’ospite, il sesso, il parto vaginale o cesareo, l’età, le condizioni ambientali non alimentari, gli stress, i farmaci, le malattie e soprattutto le abitudini alimentari. Poiché il microbiota intestinale umano dipende da così tanti fattori, la sua composizione cambia continuamente ogni giorno.
In condizioni di salute, le diverse popolazioni microbiche vivono in un rapporto armonico e mutualistico con se stesse e con l’ospite. In questa condizione, chiamata “eubiosi”, l’ecosistema intestinale è ben bilanciato. Lo stato eubiotico è caratterizzato da un’elevata diversità microbica, con una marcata prevalenza di microbi potenzialmente benefici per l’organismo, in quanto influenzano praticamente tutte le funzioni intestinali: digestione e produzione di energia, immunità mucosale, integrità della barriera intestinale, protezione dai patogeni, produzione di vitamine e altri metaboliti utili, come gli acidi grassi a catena corta (SCFA). Inoltre, nello stato eubiotico la composizione del microbiota intestinale è benefica per la funzionalità di tutti gli organi dell’ospite, incluso il cervello.
5. Effetti del cibo sul microbiota intestinale
Il microbiota intestinale dipende da noi per il suo sostentamento; infatti, il cibo che scegliamo di mangiare determina la composizione del microbiota intestinale, nutrendo una o l’altra popolazione microbica e favorendone così la crescita [21–24].
Per spiegare come l’assunzione di cibo determini la composizione del nostro microbiota intestinale, per semplicità possiamo ridurre le nostre abitudini alimentari a due soli tipi di dieta fondamentali: (1) la dieta vegetariana [VD], che è una dieta ipocalorica e ricca di fibre; e (2) la dieta animale “occidentale” [WD], che è una dieta ipercalorica, prevalentemente carnivora, ricca di acidi grassi saturi e carboidrati raffinati, e spesso associata ad alimenti trasformati industrialmente [25]. La [VD] è adatta solo a quelle popolazioni microbiche intestinali in grado di digerire i carboidrati complessi delle fibre, che non possiamo degradare. Le fibre sono il carburante ideale per i batteri appartenenti al tipo Bacteroidetes, come la Prevotella. In cambio, producono molecole utili, come gli SCFA, in particolare il butirrato [26]. I batteri [VD] sono associati all’eubiosi intestinale, all’elevata biodiversità, all’integrità della barriera intestinale e alla salute umana. Il caso della dieta occidentale, povera di fibre, è ovviamente diverso. La dieta occidentale è preferita dalle popolazioni microbiche che non possiedono i meccanismi per la digestione dei carboidrati complessi presenti nelle fibre. L’alimentazione dei batteri [WD], più adatti a raccogliere l’energia assunta in eccesso con la dieta occidentale, porta alla produzione di acidi biliari, tossici per molti batteri [VD]. Pertanto, la relazione reciproca tra le diverse popolazioni microbiche viene persa. Il risultato è una significativa diminuzione della biodiversità del microbiota e uno stato disbiotico, che è la premessa per l’infiammazione intestinale, se persiste nel tempo. Per evitare la disbiosi e l’infiammazione intestinale, è opportuno preferire una dieta prevalentemente vegetariana. È opportuno sottolineare a questo punto che in condizioni di salute il cibo interagisce con il microbiota intestinale anche se non è completamente digerito, mentre i suoi effetti sul metabolismo si verificano solo attraverso le molecole completamente digerite, dopo l’assorbimento e quindi al di fuori dell’intestino.
Vedi II parte
Back
