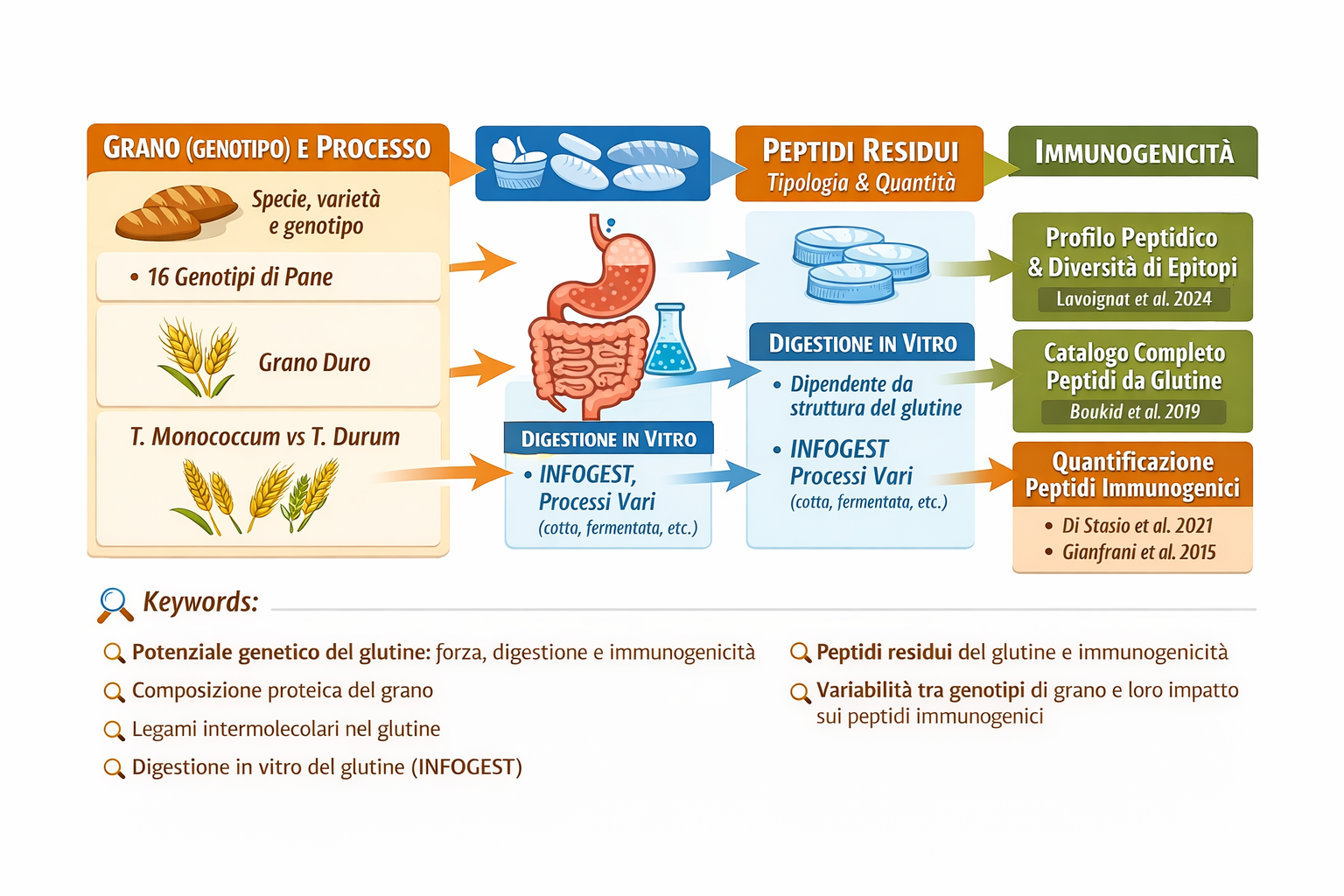
(approfondimento 3 di Potenziale genetico e condizioni di processo nella determinazione della forza del glutine, della digeribilità e dell’immunogenicità)
Il valore W non riflette direttamente il numero o la forza dei legami intrinseci delle proteine del grano, ma rappresenta una misura funzionale della resistenza del network proteico formatosi durante l’impasto. Tale network è il risultato dell’interazione tra potenziale genetico di polimerizzazione e capacità delle proteine di riorganizzarsi e stabilire nuovi legami intermolecolari sotto le condizioni di processo.
Il valore W misura la “forza delle proteine” del grano?
No.
Il valore W (alveografo Chopin) misura l’energia necessaria per deformare e rompere una bolla di impasto, quindi descrive la resistenza meccanica del network proteico che si forma dopo idratazione e impasto. Non misura direttamente né la struttura delle singole proteine né la forza dei loro legami interni.
Il valore W rappresenta la forza dei legami presenti nelle gliadine e nelle glutenine nel chicco?
No.
Nel chicco, le gliadine possiedono soprattutto legami disolfuro intramolecolari, mentre le glutenine sono parzialmente polimerizzate tramite disolfuri intermolecolari. Tuttavia, questi legami servono principalmente a stabilizzare le singole molecole o piccoli aggregati e non corrispondono al network responsabile della forza dell’impasto.
Il glutine funzionale si costruisce soprattutto durante l’impasto.
Allora cosa riflette realmente il valore W?
Il valore W riflette la resistenza complessiva della rete proteica formatasi durante l’impasto, cioè:
quanta rete è stata costruita
quanto è continua
quanto è capace di opporsi alla deformazione
In altre parole, W è una misura funzionale del network, non una misura chimica dei legami.
In che modo il corredo genetico del grano influenza W?
Il corredo genetico influenza:
tipo e quantità di subunità di glutenina
numero e posizione dei residui di cisteina
rapporto glutenine/gliadine
Questi fattori determinano il potenziale di polimerizzazione, ossia la capacità teorica delle proteine di partecipare alla formazione di legami intermolecolari durante l’impasto.
Il genotipo stabilisce quindi quanto grande e complessa può diventare la rete, non quanto è già grande nel chicco.
Il valore W dipende solo dal potenziale genetico?
No.
W dipende sia dal potenziale genetico sia dalla capacità delle proteine di riorganizzarsi e creare nuovi legami durante l’impasto.
Questa capacità è influenzata da:
mobilità delle catene proteiche
accessibilità dei gruppi reattivi
velocità di scambio tiolo–disolfuro
condizioni di idratazione, energia meccanica, temperatura e stato redox
Due grani con potenziale genetico simile possono quindi sviluppare reti di forza diversa.
È possibile che un grano con minore potenziale genetico sviluppi un W superiore?
Sì, entro certi limiti.
Un grano con meno siti teorici di cross-linking ma con proteine più mobili e reattive può sfruttare meglio il proprio potenziale e formare una rete più efficiente rispetto a un grano con potenziale teorico maggiore ma scarso sfruttamento di tale potenziale.
Esiste un limite massimo a questa compensazione?
Sì.
Un grano povero di glutenine polimerizzabili non potrà mai raggiungere i valori di W tipici dei grani forti, anche con condizioni di processo ideali.
Il potenziale genetico impone quindi un tetto superiore, mentre il processo determina quanto ci si avvicina a quel tetto.
Si può quindi dire che W misura il “numero di legami” presenti?
No.
W non misura il numero di legami, ma l’effetto meccanico collettivo del network che quei legami contribuiscono a stabilizzare.
✅ Conclusione
Il valore W non riflette né la forza dei legami interni delle gliadine e delle glutenine né il numero di legami presenti nel chicco. Esso rappresenta una misura funzionale della resistenza del network proteico che si forma durante l’impasto.
Tale network è il risultato dell’interazione tra:
potenziale genetico di polimerizzazione (ciò che è possibile costruire)
capacità di riorganizzazione e di formazione di nuovi legami sotto le condizioni di processo (ciò che viene effettivamente costruito)
In sintesi:
✔ Conta soprattutto la rete che si forma nel glutine
✔ Ma questa rete è limitata da ciò che esiste all’origine
Approfondimento
Da cosa è determinato il potenziale genetico di partenza del grano
Il potenziale genetico di partenza di un grano, inteso come capacità intrinseca delle sue proteine di formare una rete di glutine estesa e strutturalmente efficace, è determinato principalmente dalla composizione e dall’organizzazione molecolare delle proteine di riserva. In particolare, quattro fattori giocano un ruolo centrale.
1 – Tipo di subunità HMW-GS e LMW-GS
Le subunità di glutenina ad alto peso molecolare (HMW-GS) costituiscono l’ossatura principale dei polimeri di glutenina. Diverse varianti alleliche codificano subunità con differente lunghezza, conformazione e numero di residui di cisteina.
Alcune subunità favoriscono la formazione di catene più lunghe e ramificate, mentre altre portano a polimeri più corti. Di conseguenza, il tipo di HMW-GS presente influenza direttamente la capacità di costruire un telaio elastico continuo.
Le subunità a basso peso molecolare (LMW-GS) svolgono un ruolo complementare, fungendo da elementi di connessione e ramificazione tra catene principali. La combinazione HMW-GS/LMW-GS definisce quindi l’architettura di base dei polimeri.
Impatto sul potenziale: determina la struttura portante della rete.
2 – Numero e posizione delle cisteine
I residui di cisteina rappresentano i siti chimici attraverso cui si formano i legami disolfuro.
Non conta solo quanti residui di cisteina siano presenti, ma anche dove si trovino nella sequenza proteica. Cisteine posizionate in regioni esposte favoriscono la formazione di legami intermolecolari, mentre cisteine localizzate in regioni stericamente schermate tendono a formare legami intramolecolari.
Impatto sul potenziale: definisce quanti punti di connessione sono teoricamente disponibili per costruire il network.
3 – Rapporto glutenine/gliadine
Le glutenine sono responsabili soprattutto dell’elasticità e della tenacità, mentre le gliadine contribuiscono principalmente alla viscosità e all’estensibilità.
Un rapporto spostato verso le glutenine favorisce la formazione di reti più robuste; un eccesso relativo di gliadine tende invece a diluire la continuità del network.
Impatto sul potenziale: determina quanta “impalcatura” rispetto a quanta “fase fluida” è disponibile.
4 – Distribuzione dimensionale dei polimeri
Già nella farina esiste una distribuzione di polimeri di glutenina di diversa dimensione. Alcuni grani presentano una quota maggiore di polimeri di grandi dimensioni (spesso indicati come GMP, glutenin macropolymer).
Una distribuzione iniziale orientata verso polimeri più grandi favorisce la formazione di una rete continua durante l’impasto.
Impatto sul potenziale: indica il livello di pre-organizzazione verso strutture estese.
Sintesi
Il potenziale genetico di partenza non corrisponde al numero di legami già presenti nel chicco, ma alla capacità intrinseca delle proteine di partecipare alla costruzione di una rete estesa durante l’impasto.
Esso è determinato principalmente da:
✔ Tipo di subunità HMW-GS e LMW-GS
✔ Numero e posizione delle cisteine
✔ Rapporto glutenine/gliadine
✔ Distribuzione dimensionale dei polimeri
Questi fattori definiscono ciò che è chimicamente e strutturalmente possibile. Le condizioni di processo stabiliscono quanto di questo potenziale verrà effettivamente espresso nella rete di glutine finale.