Potenziale genetico e condizioni di processo nella determinazione della forza del glutine, della digeribilità e dell’immunogenicità
Premessa
Il glutine è il complesso proteico che si forma quando le proteine di riserva del frumento — principalmente gliadine e glutenine — vengono idratate e sottoposte a lavorazione meccanica. Durante questo processo esse si organizzano in una rete tridimensionale continua, responsabile delle proprietà viscoelastiche dell’impasto.
La forza del glutine non rappresenta una proprietà intrinseca e immutabile delle singole proteine del frumento, ma è una caratteristica emergente dell’organizzazione supramolecolare che si sviluppa quando le proteine di riserva vengono idratate e sottoposte a energia meccanica durante l’impasto (Shewry & Tatham, 1997; Wieser, 2023). La qualità del glutine è pertanto il risultato dell’interazione tra composizione molecolare di partenza e trasformazioni strutturali indotte dal processo.
Nel chicco, le gliadine sono costituite prevalentemente da proteine monomeriche stabilizzate da legami disolfuro intramolecolari, mentre le glutenine sono presenti anche in forma di polimeri stabilizzati da legami disolfuro intermolecolari, che costituiscono la base strutturale dell’elasticità del glutine (Shewry & Tatham, 1997; Wieser, 2023). I ponti disolfuro rappresentano dunque i principali cross-link covalenti responsabili della formazione di una rete proteica continua.
È fondamentale distinguere tra forza del singolo legame e capacità di formare una rete estesa di legami. Dal punto di vista chimico, l’energia di legame di un ponte disolfuro è sostanzialmente costante; le differenze tra varietà non derivano da legami “più forti”, bensì da variazioni nel numero, nella posizione e nell’accessibilità dei residui di cisteina, nonché dalla composizione in subunità di glutenina ad alto e basso peso molecolare (Wieser, 2023). Tali caratteristiche definiscono il potenziale genetico di cross-linking, ossia la predisposizione intrinseca delle proteine a partecipare alla formazione di legami intermolecolari.
L’esistenza e l’importanza strutturale dei ponti disolfuro nel glutine sono state confermate mediante identificazione diretta delle connessioni S–S attraverso spettrometria di massa, che ha consentito di mappare specifici legami intra- e intermolecolari nelle proteine del glutine (Lutz et al., 2012). Queste evidenze supportano l’idea che il network del glutine sia stabilizzato da una fitta rete di connessioni covalenti.
Durante l’impasto, il potenziale genetico viene convertito in struttura reale attraverso processi dinamici di rottura e riformazione dei legami disolfuro, principalmente tramite reazioni di scambio tiolo–disolfuro (Lagrain et al., 2010). Di conseguenza, la rete del glutine non coincide semplicemente con i polimeri presenti nel chicco, ma rappresenta una struttura riorganizzata che si sviluppa in funzione di idratazione, energia meccanica, temperatura e condizioni ossido-riduttive.
La composizione proteica influisce anche sull’architettura dei polimeri che si formano. È stato dimostrato che alcune gliadine contenenti un numero dispari di residui di cisteina possono essere incorporate nelle frazioni polimeriche e agire come elementi che limitano o modulano l’estensione delle catene (Vensel et al., 2014). Ciò evidenzia che la qualità del network dipende non solo dalla quantità di proteine polimeriche, ma anche dalla loro natura molecolare.
Parallelamente, studi classici hanno mostrato che i polimeri di glutenina subiscono fenomeni di depolimerizzazione e ripolimerizzazione durante la lavorazione dell’impasto, e che il contenuto di glutenin macropolymer (GMP) è strettamente correlato alla forza dell’impasto e del glutine (Weegels et al., 1996). Questo comportamento dinamico sottolinea il ruolo determinante delle condizioni di processo nel modulare l’espressione del potenziale genetico.
Implicazioni strutturali sulla digeribilità
La forza del glutine e la struttura del network proteico non influenzano soltanto le proprietà reologiche dell’impasto, ma anche l’accessibilità delle proteine e degli amidi agli enzimi digestivi. Studi recenti mostrano che glutini caratterizzati da una rete più compatta ed estesa sono associati a una minore velocità di digestione dell’amido e a una differente cinetica di degradazione proteica, suggerendo che la matrice del glutine funzioni come barriera fisica all’azione enzimatica (Zou et al., 2022).
A livello molecolare, le proteine del glutine sono ricche di prolina e glutammina, una composizione che conferisce intrinseca resistenza alle principali proteasi gastrointestinali. Di conseguenza, la digestione del glutine porta frequentemente alla formazione di peptidi relativamente lunghi e difficilmente degradabili (Di Stasio et al., 2025).
Tra questi, frammenti derivati dalle α-gliadine — come il noto peptide 33-mer — mostrano un’elevata resistenza alla proteolisi e contengono epitopi riconosciuti dal sistema immunitario nei soggetti affetti da celiachia (Hernández-Figueroa et al., 2025). La probabilità di formazione e persistenza di tali peptidi è influenzata sia dal genotipo del frumento sia dall’organizzazione strutturale del glutine.
Ruolo del processo nella modulazione dei peptidi
Le condizioni di processo, in particolare la fermentazione, possono modificare significativamente la struttura del glutine e il profilo dei peptidi generati durante la digestione. La fermentazione con lievito madre, grazie all’attività combinata di enzimi endogeni della farina e proteasi microbiche, è in grado di parzialmente idrolizzare le proteine del glutine e alterare la distribuzione dei peptidi immunogenici rilasciati (Ogilvie et al., 2021).
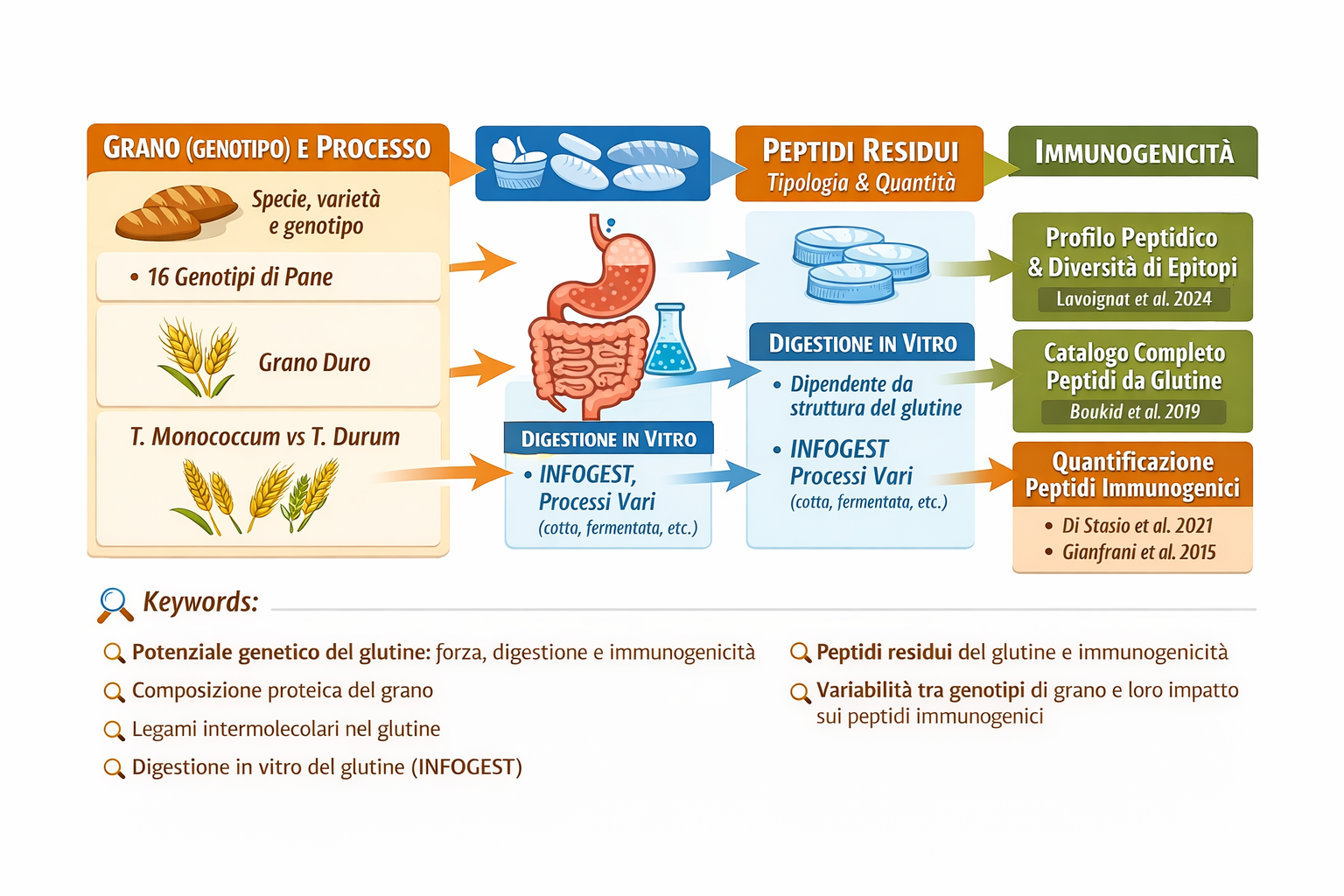
Analisi peptidomiche su pani sottoposti a digestione in vitro mostrano una notevole diversità di peptidi, correlata al genotipo del grano, alle condizioni agronomiche e alle tecnologie di trasformazione (Lavoignat et al., 2024). Ciò conferma che il profilo peptidico finale non è determinato esclusivamente dalla sequenza proteica, ma anche dall’architettura del network e dalla sua storia di processo.
L’utilizzo di protocolli di digestione semi-dinamici standardizzati (come INFOGEST) consente di simulare in modo realistico le fasi orale, gastrica e intestinale, permettendo di quantificare la formazione di peptidi resistenti e potenzialmente tossici (Freitas et al., 2022). Tecniche avanzate di cromatografia liquida accoppiata a spettrometria di massa consentono la quantificazione assoluta di tali frammenti e la valutazione comparativa di varietà e processi.
In parallelo, l’impiego di enzimi supplementari o di microrganismi selezionati è stato esplorato come strategia per incrementare la degradazione dei peptidi di glutine particolarmente resistenti, dimostrando che interventi mirati possono ridurre significativamente la concentrazione di frammenti problematici (Dunaevsky et al., 2021).
Visione integrata
Nel loro insieme, queste evidenze conducono a una visione integrata:
La composizione molecolare di partenza definisce il limite superiore della connettività possibile del glutine.
Il processo di impasto e fermentazione determina quanto di questo potenziale viene effettivamente espresso.
La struttura risultante del network influenza non solo la forza tecnologica, ma anche la digeribilità e il profilo dei peptidi rilasciati.
In sintesi:
✔ Conta soprattutto la rete che si forma nel glutine
✔ Ma questa rete è limitata da ciò che esiste all’origine
✔ E la rete risultante condiziona anche il destino digestivo delle proteine
Approfondimenti tematici
Il glutine viene spesso descritto come una caratteristica intrinseca del grano o della farina. In realtà, le evidenze scientifiche mostrano che le sue proprietà tecnologiche e biologiche derivano dall’interazione tra genetica del grano, composizione proteica e condizioni di processo.
La forza dell’impasto, la digeribilità delle proteine e la generazione di peptidi potenzialmente immunogenici non sono aspetti separati, ma espressioni diverse della stessa struttura: il network del glutine che si forma durante l’impasto e si modifica durante la fermentazione e la trasformazione.
Il potenziale genetico delle proteine del frumento stabilisce quali legami molecolari possono formarsi; il processo tecnologico determina quanto di questo potenziale viene effettivamente espresso; la struttura risultante condiziona sia il comportamento in panificazione sia il destino digestivo delle proteine.
Questa serie di approfondimenti analizza i principali elementi di questo sistema:
perché la forza del glutine dipende soprattutto dai legami intermolecolari;
perché il peptide 33-mer è un riferimento centrale negli studi sull’immunogenicità;
che cosa misura realmente il valore W della farina;
come forza tecnologica e immunogenicità sono legate alla genetica del grano;
quali peptidi residui si osservano dopo digestione in vitro;
perché resistenza alla digestione e immunogenicità non coincidono sempre.
L’obiettivo è fornire una chiave di lettura basata su dati scientifici che permetta di interpretare la qualità del glutine non come un valore assoluto, ma come il risultato di una catena di scelte genetiche e tecnologiche.
1 – Perché i legami intermolecolari “fanno” la forza del glutine
2 –Il peptide 33-mer — perché è un riferimento fondamentale
3 – Il valore della forza della farina “W”
4 – Grani, immunogenicità e forza del glutine: basi genetiche e marker applicativi
5 – Peptidi residui del grano dopo digestione in vitro completa: tipologia, quantità, immunogenicità (e perché conta la diversità dei grani)
6 – Immunogenicità e resistenza alla digestione nel glutine (e perché non coincidono sempre)
Bibliografia
Shewry, P. R., & Tatham, A. S. (1997) – Disulphide bonds in wheat gluten proteins. Journal of Cereal Science, 25, 207–227. https://doi.org/10.1006/jcrs.1996.0100
Wieser, H. (2023) – Chemistry of wheat gluten proteins: Qualitative composition. Cereal Chemistry. https://doi.org/10.1002/cche.10572
Lagrain, B., Goderis, B., Brijs, K., & Delcour, J. A. (2010) – Molecular basis of processing wheat gluten toward biobased materials. Biomacromolecules, 11, 533–541. https://doi.org/10.1021/bm100008p
Lutz, E., Wieser, H., & Koehler, P. (2012) – Identification of disulfide bonds in wheat gluten proteins by means of mass spectrometry/electron transfer dissociation. Journal of Agricultural and Food Chemistry, 60, 3708–3716. https://doi.org/10.1021/jf204973u
Vensel, W. H., Tanaka, C. K., Cai, N., Wong, J. H., & Buchanan, B. B. (2014) – Protein composition of wheat gluten polymer fractions determined by quantitative two-dimensional gel electrophoresis and tandem mass spectrometry. Proteome Science, 12, 8. https://doi.org/10.1186/1477-5956-12-8
Weegels, P. L., van de Pijpekamp, A. M., Graveland, A., Hamer, R. J., & Schofield, J. D. (1996) – Depolymerisation and re-polymerisation of wheat glutenin during dough processing. I. Relationships between glutenin macropolymer content and quality parameters. Journal of Cereal Science, 23, 103–111. https://doi.org/10.1006/jcrs.1996.0010
Zou, X., Wang, X., Pang, P., et al. (2022) – Effects of composition and strength of wheat gluten on starch structure, digestion properties and the underlying mechanism. Foods, 11(21), 3432. https://doi.org/10.3390/foods11213432 (MDPI)
Di Stasio, L., & Mamone, G. (2025) – Gluten proteins: Beneficial factors and toxic triggers in human health. Foods, 14(19), 3403. https://doi.org/10.3390/foods14193403 (MDPI)
Ogilvie, O. J., et al. (2021) – A case study of the response of immunogenic gluten peptides to sourdough fermentation and in vitro digestion. Journal of Cereal Science, (anno e volume specifici da confermare). (Pubblicazione su rivista scientifica peer-reviewed; fermentazione e profilo peptidico)
Lavoignat, M., et al. (2024) – Peptidomics analysis of in vitro digested wheat breads. Food Chemistry, (anno e volume specifici da confermare). (Studio peptidomico post-digestione)
Freitas, D., et al. (2022) – Digestion of protein and toxic gluten peptides in wheat-based foods using the INFOGEST protocol. Frontiers in Nutrition, (anno e numero articoli specifici da confermare). (Digestione semi-dinamica INFOGEST)
Dunaevsky, Y. E., et al. (2021) – Effective degradation of gluten and its fragments by supplemental enzymes. Nutrients, 13, 826. https://doi.org/10.3390/nu13082612
Back
