Premessa:
I grani antichi sono varietà di frumento coltivate da secoli che hanno subito pochissime o nessuna modifica genetica da parte dell’uomo. Sono cereali che mantengono caratteristiche molto simili a quelle originarie, prima dei programmi intensivi di selezione e ibridazione avviati soprattutto nel secondo dopoguerra.
I grani moderni, invece, sono stati selezionati per aumentare resa agricola, resistenza alle malattie e facilità di lavorazione, ottenendo piante più produttive ma con una composizione proteica e strutturale differente.
In sintesi:
I grani antichi privilegiano naturalità, biodiversità e tradizione
I grani moderni privilegiano produttività e standardizzazione
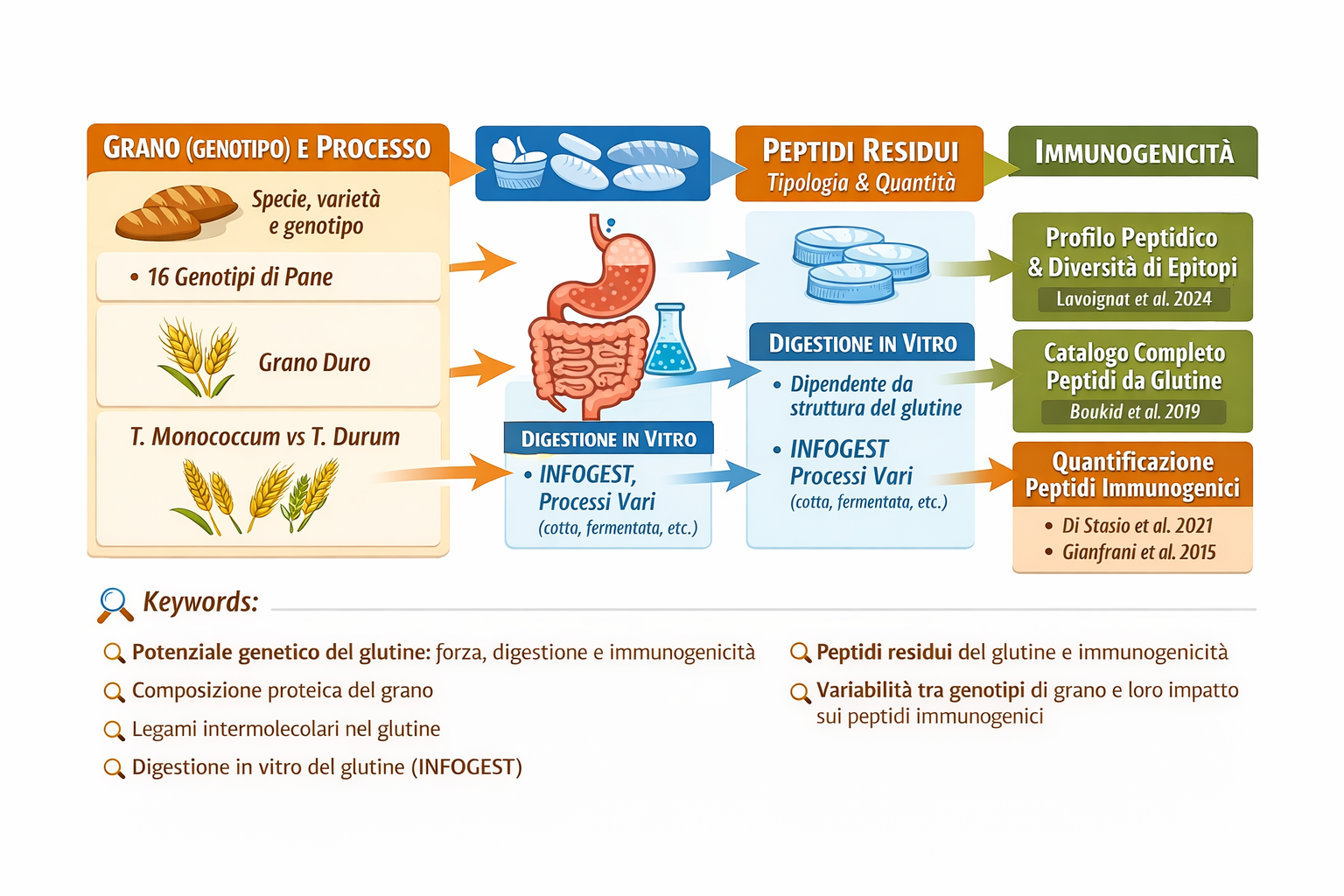
La scienza evidenzia che la vera differenza tra grani antichi e moderni non risiede tanto nella quantità totale di proteine, quanto nella loro qualità e struttura. Questa nota integra le evidenze sulla struttura del glutine citate nel testo.
A – Studi scientifici (CREA, Università di Bologna, MDPI): Ecco una sintesi dei principali risultati emersi:
A1. Forza del Glutine (Valore W)
La differenza più marcata riguarda le proprietà reologiche, ovvero come si comporta l’impasto.
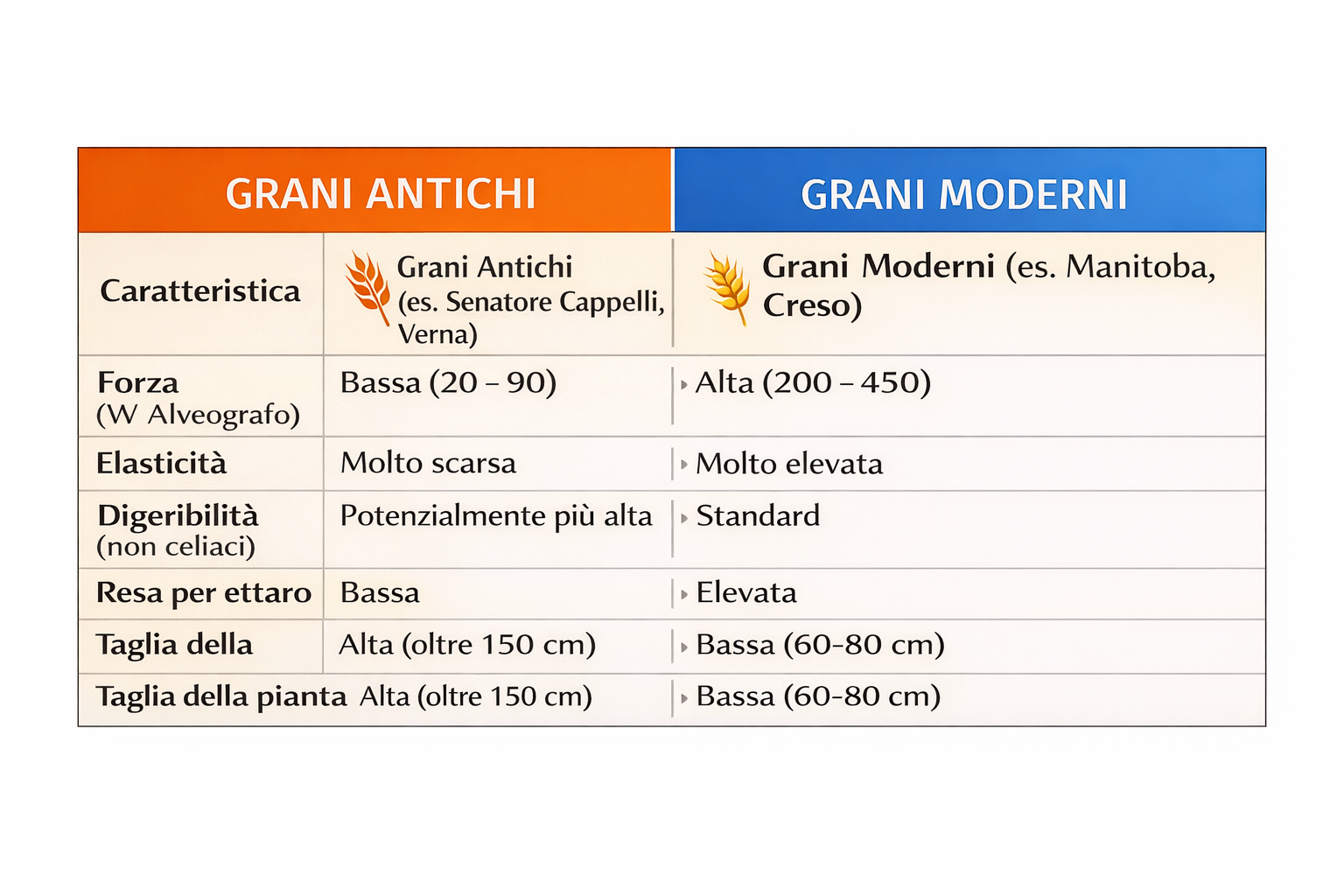
Grani Moderni: Sono stati selezionati per avere un glutine forte (W elevato, spesso tra 200 e 400). Questo crea una maglia glutinica tenace ed elastica, ideale per la panificazione industriale e la tenuta in cottura della pasta.
Grani Antichi: Presentano un glutine debole (W basso, spesso tra 20 e 90). La maglia glutinica è più fragile e meno elastica, rendendo la lavorazione meccanica più difficile ma, secondo alcuni studi, rendendo il prodotto più facilmente “attaccabile” dagli enzimi digestivi.
A2. Rapporto Gliadine/Glutenine
Il glutine è formato da due tipi di proteine: gliadine (responsabili dell’estensibilità e della tossicità per i celiaci) e glutenine (responsabili dell’elasticità e della forza).
Ricerche MDPI: Hanno dimostrato che i grani antichi (come il Monococco o il Farro) hanno spesso un rapporto gliadine/glutenine molto più alto rispetto al grano tenero moderno.
Conseguenza: Questo spiega perché gli impasti di grani antichi siano più “appiccicosi” e meno capaci di trattenere i gas della lievitazione, risultando in pani meno voluminosi.
A3. Quantità di Glutine e Tossicità
I grani antichi non contengono necessariamente meno glutine totale di quelli moderni.
Contenuto proteico: Molte varietà antiche hanno una percentuale proteica superiore (14-18%) rispetto ai grani moderni (11-14%).
Celiachia: Studi del CREA e della Fondazione Veronesi confermano che i grani antichi contengono gli stessi epitopi tossici (e talvolta in quantità maggiore) dei grani moderni. Pertanto, non sono assolutamente adatti ai celiaci.
Sensibilità al Glutine (NCGS): Alcune ricerche (es. Prof. Spisni, Univ. Bologna) suggeriscono che la diversa struttura del glutine e la presenza di altri composti (come i polifenoli) nei grani antichi possano ridurre i marker dell’infiammazione intestinale in chi non è celiaco ma soffre di sensibilità.
Tabella Comparativa Sintetica
B – Comparative Study on Gluten Protein Composition of Ancient (Einkorn, Emmer and Spelt) and Modern Wheat Species (Durum and Common Wheat)
Autori: Sabrina Geisslitz, Christina Ludwig, Katharina Anne Scherf, Peter Koehler.
Anno: 2019. Rivista: Foods (MDPI). DOI: 10.3390/foods8090409
Sintesi
Obiettivo: Lo studio ha analizzato 300 campioni di cereali (15 cultivar per ogni specie: monococco, dicocco, farro, grano duro e grano tenero), coltivati in quattro diverse località per eliminare le variabili ambientali e isolare le differenze genetiche.
Risultati principali sulla forza del glutine:
Quantità vs Qualità: Contrariamente alla percezione comune, le specie antiche (einkorn, emmer e spelt) presentano un contenuto proteico e di glutine totale superiore rispetto al grano tenero moderno.
Il rapporto Gliadine/Glutenine: La differenza cruciale risiede nel rapporto tra le componenti del glutine. Il grano moderno ha un contenuto molto più elevato di glutenine, le proteine responsabili dell’elasticità e della forza (W).
Debolezza tecnologica: Nelle specie antiche, il rapporto gliadine/glutenine è estremamente alto (fino a 12:1 nel monococco, contro il <3.8:1 del grano moderno). Questo determina un glutine “debole”, che non riesce a formare una maglia tenace, risultando in volumi di panificazione inferiori ma in una struttura proteica meno complessa.
Conclusione: Lo studio conferma che il miglioramento genetico moderno non ha aumentato la quantità di glutine, ma ne ha modificato radicalmente la qualità polimerica per renderlo più forte e adatto ai processi industriali.
C – Differential Physiological Responses Elicited by Ancient and Heritage Wheat Cultivars Compared to Modern Ones . Riguardo la digeribilità
Autore: Enzo Spisni et al. Anno: 2019. DOI: 10.3390/nu11122879
Focus: Dimostra come il glutine dei grani antichi provochi una minore risposta infiammatoria a livello intestinale nei test in vitro e in vivo.
1. Il Paradosso Nutrizionale
Lo studio esordisce con un dato controintuitivo: dal punto di vista puramente biochimico (macro e micronutrienti), i grani antichi e moderni sono molto simili. Entrambi contengono glutine, carboidrati e una densità calorica paragonabile. Tuttavia, quando si passa dai test “in provetta” agli studi clinici sull’uomo, le risposte dell’organismo cambiano drasticamente.
2. Risposta Infiammatoria e “Forza” del Glutine
Il cuore della ricerca riguarda il modo in cui il corpo reagisce alle diverse strutture proteiche:
Glutine Moderno: La selezione genetica (iniziata negli anni ’70 per aumentare la resa e la lavorabilità industriale) ha creato una rete glutinica estremamente tenace e complessa. Questa “forza” (l’alto valore W) rende il glutine più resistente agli enzimi digestivi umani.
Glutine Antico: Le varietà antiche hanno un glutine “debole” e meno polimerizzato. Lo studio suggerisce che questa struttura semplificata venga frammentata più facilmente durante la digestione, riducendo l’esposizione dell’intestino a peptidi pro-infiammatori.
3. Effetti Anti-infiammatori e Antiossidanti
L’analisi di diversi trial clinici condotti su soggetti sani e su pazienti con patologie (come la sindrome dell’intestino irritabile – IBS) ha mostrato che:
La sostituzione del grano moderno con quello antico porta a una riduzione significativa delle citochine pro-infiammatorie nel sangue (come l’interleuchina-6 e il TNF-alfa).
Si osserva un miglioramento dei parametri metabolici, inclusi i livelli di colesterolo totale e glicemia.
4. Il Ruolo del Microbiota Intestinale
Una parte fondamentale della ricerca (approfondita anche in studi successivi dello stesso team) evidenzia come il consumo di grani antichi favorisca la crescita di batteri benefici che producono acidi grassi a catena corta (SCFA), come il butirrato. Questi composti hanno un effetto protettivo sulla barriera intestinale, riducendo la cosiddetta “leaky gut” (permeabilità intestinale), spesso associata al consumo eccessivo di grani moderni raffinati.
5. Conclusioni dello studio
Gli autori concludono che, sebbene i grani antichi non siano una cura per la celiachia (in quanto contengono comunque glutine tossico per i celiaci), essi rappresentano una scelta nettamente superiore per:
Chi soffre di Sensibilità al Glutine non Celiaca (NCGS).
Chi soffre di Sindrome dell’Intestino Irritabile (IBS).
Persone sane che desiderano ridurre lo stato infiammatorio basale dell’organismo.
In sintesi, la “forza” tecnologica del grano moderno, tanto amata dall’industria per produrre pane e pasta in tempi rapidi, sembra essere il fattore principale che mette sotto sforzo il nostro sistema immunitario e digerente.