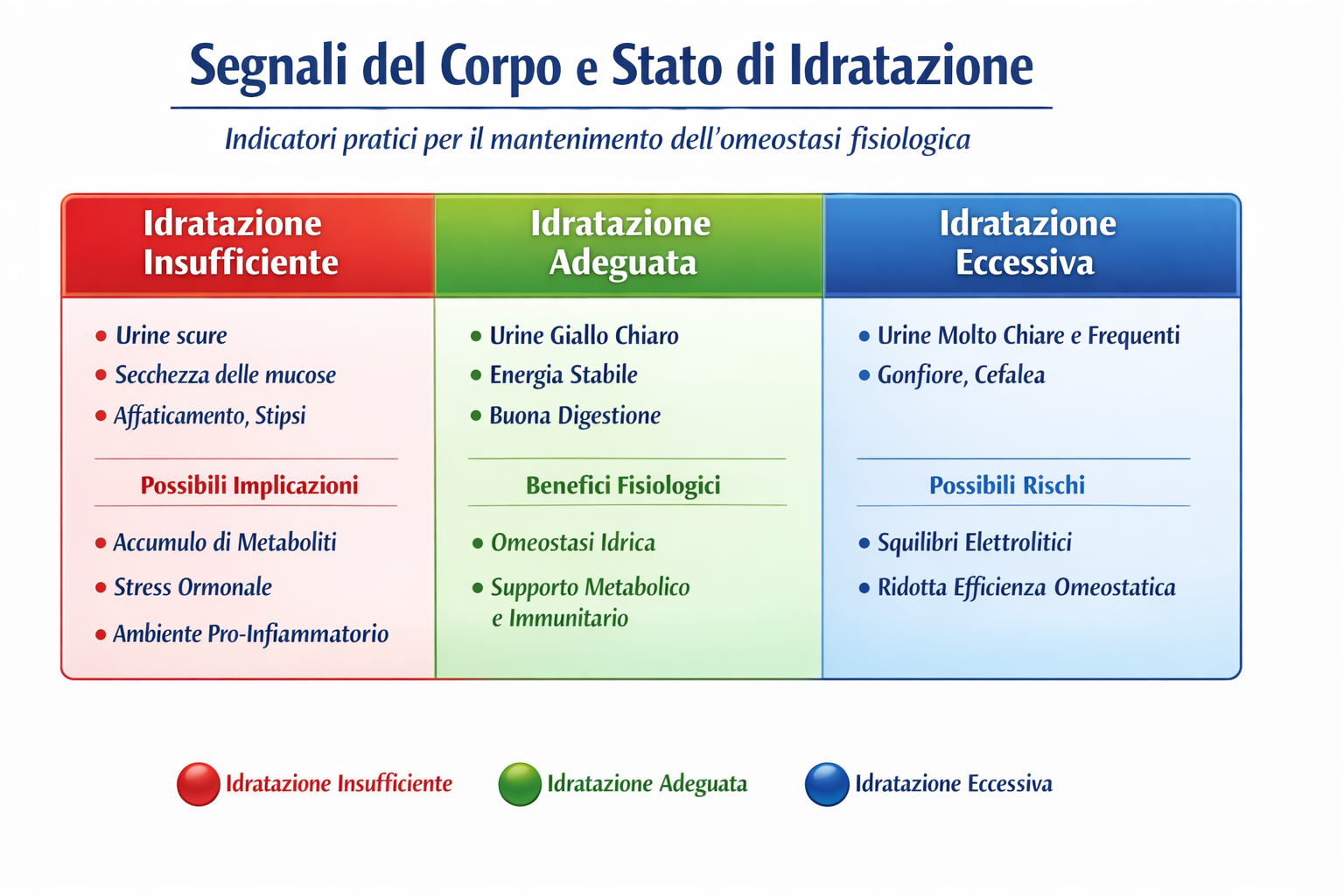
(con rimandi alla parte scientifica)
Perché l’acqua aiuta a spegnere l’infiammazione
1️⃣ Diluisce e facilita l’eliminazione delle sostanze infiammatorie
(→ vedi Sez. 2.1; Sez. 3.1)
Durante uno stato infiammatorio l’organismo produce:
-
citochine
-
mediatori infiammatori
-
scorie metaboliche
L’acqua:
-
aumenta il volume del plasma
-
facilita la funzione di filtrazione renale
-
supporta la detossificazione epatica
-
accelera l’eliminazione tramite urine e bile
⚠️ In condizioni di disidratazione queste molecole restano più concentrate → infiammazione persistente.
2️⃣ Migliora la circolazione e la “pulizia” dei tessuti
(→ vedi Sez. 3.1)
Un’idratazione adeguata rende il sangue:
-
meno viscoso
-
più fluido
-
più efficiente nel trasporto di ossigeno e nutrienti
Questo consente alle cellule di:
-
ripararsi più efficacemente
-
smaltire più rapidamente i prodotti dell’infiammazione
3️⃣ Supporta il sistema linfatico
(→ vedi Sez. 3.1)
Il sistema linfatico è una rete di drenaggio dell’infiammazione cronica.
La sua funzione dipende in modo critico dalla disponibilità di acqua.
In caso di apporto idrico insufficiente:
-
la linfa ristagna
-
le tossine restano nei tessuti
-
l’infiammazione di basso grado si amplifica
4️⃣ Regola l’equilibrio intestinale
(→ vedi Sez. 3.2; Sez. 6.1)
L’infiammazione di basso grado è frequentemente associata a:
-
stipsi
-
disbiosi intestinale
-
aumento della permeabilità intestinale
L’acqua:
-
migliora il transito intestinale
-
favorisce l’eliminazione delle endotossine
-
riduce lo stimolo infiammatorio sistemico
L’intestino agisce come hub centrale dell’infiammazione sistemica.
5️⃣ Riduce lo stress fisiologico
(→ vedi Sez. 3.3; Sez. 4)
La disidratazione è interpretata dall’organismo come stress biologico.
Conseguenze fisiologiche:
-
aumento del cortisolo
-
maggiore produzione di mediatori infiammatori
Bere adeguatamente = riduzione dello stress → riduzione dell’infiammazione.
Effetti che vanno oltre l’infiammazione di basso grado
(→ vedi Sez. 7)
Un’idratazione adeguata contribuisce anche a:
-
riduzione di dolori articolari e muscolari
-
miglior recupero post-allenamento
-
diminuzione delle cefalee ricorrenti
-
riduzione dell’affaticamento cronico
-
miglioramento delle condizioni infiammatorie cutanee
Concetto chiave
(→ vedi Conclusioni)
L’acqua non è un antinfiammatorio diretto,
ma la condizione necessaria affinché l’organismo
possa spegnere autonomamente l’infiammazione.
Cosa rende l’acqua ancora più efficace
(→ vedi Sez. 6; Sez. 7)
-
bere regolarmente durante la giornata
-
evitare di concentrare tutta l’assunzione in pochi momenti
-
associare minerali, soprattutto in caso di sudorazione
-
abbinarla a una dieta anti-infiammatoria
(verdure, omega-3, fibre)
Perché acqua + alimenti anti-infiammatori funzionano meglio insieme
1️⃣ L’acqua è il mezzo di trasporto dei nutrienti anti-infiammatori
(→ vedi Sez. 6.1)
Gli alimenti anti-infiammatori forniscono:
-
polifenoli
-
antiossidanti
-
minerali
-
omega-3
-
fibre
In assenza di sufficiente acqua:
-
l’assorbimento intestinale è ridotto
-
il trasporto ematico rallenta
-
l’efficacia cellulare diminuisce
Qualità nutrizionale alta, resa biologica bassa.
2️⃣ Fibra + acqua = intestino calmo = meno infiammazione
(→ vedi Sez. 6.1; Sez. 3.2)
La fibra:
-
nutre il microbiota
-
contribuisce alla riduzione dell’infiammazione intestinale
⚠️ Fibra senza acqua:
-
rallenta il transito
-
fermenta in modo disfunzionale
-
può aumentare gonfiore e stress intestinale
Acqua + fibra = eliminazione endotossine → ↓ infiammazione sistemica.
3️⃣ L’acqua attenua la risposta infiammatoria post-prandiale
(→ vedi Sez. 6.2)
Anche un pasto equilibrato genera:
-
calore metabolico
-
sottoprodotti temporanei
Bere acqua:
-
diluisce i metaboliti
-
supporta fegato e reni
-
riduce la risposta infiammatoria post-pasto
Abbinamenti chiave: cosa mangiare + come bere
(→ vedi Sez. 5; Sez. 6)
Grassi buoni
(olio EVO, avocado, frutta secca)
✔️ Anti-infiammatori
➕ Acqua:
-
migliora la fluidità ematica
-
facilita l’azione degli omega-3
Preferire l’assunzione prima del pasto. Polifenoli
(frutti di bosco, tè verde, cacao amaro)
✔️ Neutralizzano i radicali liberi
➕ Acqua:
-
favorisce la distribuzione cellulare
-
accelera l’eliminazione dei radicali neutralizzati
Verdure amare e crucifere
✔️ Supportano la funzione epatica
➕ Acqua:
-
stimola la produzione di bile
-
favorisce la detossificazione epatica
Spezie anti-infiammatorie
(curcuma, zenzero)
✔️ Modulatori infiammatori
➕ Acqua:
-
migliora la biodisponibilità
-
riduce l’irritazione gastrica
Ideali anche in acqua tiepida o tisane.
⏰ Quando bere per potenziare l’effetto anti-infiammatorio
(→ vedi Sez. 7)
-
al risveglio → attivazione intestinale e drenaggio
-
tra i pasti → supporto al trasporto dei nutrienti
-
prima dei pasti → modulazione risposta infiammatoria
-
❌ evitare grandi quantità durante i pasti
Acqua frizzante
Stimola leggermente la digestione e può aumentare il senso di sazietà.
In alcune persone facilita la digestione lenta.
Può però causare gonfiore ed eruttazioni.
Da limitare in caso di reflusso, gastrite o colon irritabile.
Idrata quanto l’acqua naturale, ma è meno neutra per lo stomaco.
Consigliata con moderazione e alternata all’acqua naturale (→ vedi Sez. 8)
Frase chiave finale
Gli alimenti anti-infiammatori spengono il fuoco.
L’acqua porta via la cenere.
Senza acqua, la cenere resta.