Note riassuntive – Punti salienti della ricerca
6. Dieta infiammatoria vs antinfiammatoria
Come mostrato nella Figura 3, la dieta occidentale, ad alto contenuto energetico, è tipicamente pro-infiammatoria, ricca di grassi animali saturi, carni rosse, patatine fritte, snack e margarine (acidi grassi trans), bevande zuccherate e zuccheri semplici, sale, cibi lavorati e condimenti elaborati. La dieta occidentale è spesso associata a uno stile di vita sedentario ed è caratterizzata dalla scarsità di fibre. Anche l’assunzione di alcol e il fumo sono pro-infiammatorie.
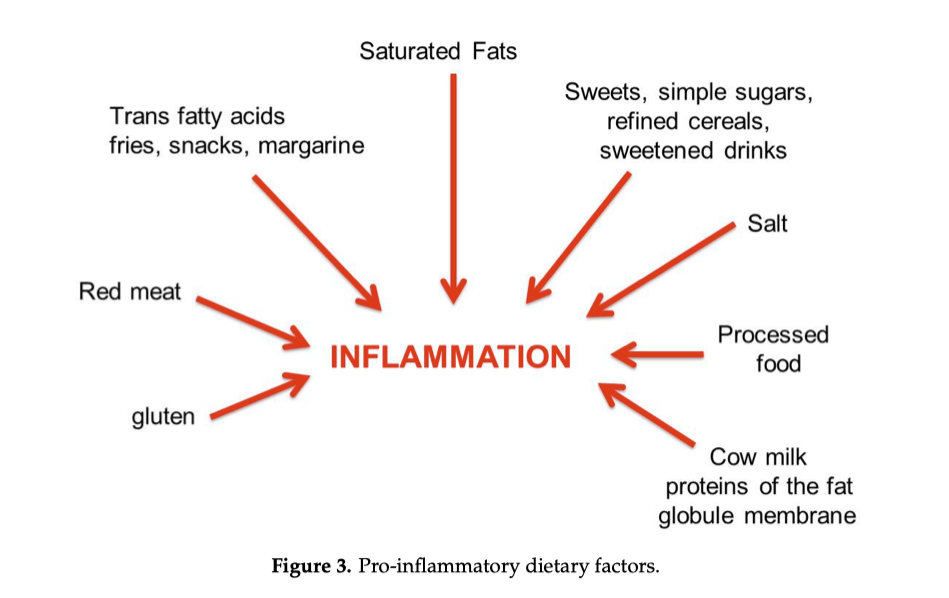
In sintesi:
Dieta pro-infiammatoria
-
carni rosse
-
grassi saturi
-
zuccheri semplici
-
alimenti ultra-processati
-
sedentarietà
-
alcol e fumo
Dieta antinfiammatoria
-
verdura
-
frutta
-
legumi
-
cereali integrali
-
pesce (omega-3)
-
olio extravergine di oliva
-
spezie
-
polifenoli
-
prebiotici e probiotici
Gli alimenti trasformati sono pro-infiammatori perché possono contenere diversi metalli chimici aggiunti, pesticidi, aromi artificiali, coloranti, erbicidi e conservanti, che hanno effetti deleteri sugli emulsionanti, antibiotici e, inoltre, metalli pesanti, microbiota e vitamine. Additivi: aromi artificiali, coloranti, conservanti, emulsionanti, antibiotici e, inoltre, alti livelli di vitamina D. Pesticidi ed erbicidi, che hanno effetti deleteri sul microbiota intestinale e sui livelli di vitamina D.
La Figura 4 mostra i fattori attivi della dieta antinfiammatoria, principalmente vegetariana e ricca di fibre. Questa dieta, dieta, che è intesa come essere povera di pane e caseinati, caseinati, si basa sull’assunzione di verdura, frutta, verdura. La Figura 4 mostra i fattori attivi della dieta antinfiammatoria, principalmente vegetariana e ricca di funghi, legumi, pesce, molluschi, crostacei, pasta integrale, cioccolato fondente, yogurt magro, frutta, funghi, legumi, pesce, molluschi, crostacei, pasta integrale, cioccolato fondente, fibre magre. Questa dieta, che è intesa come essere povera di pane e caseinati, si basa sull’assunzione di verdura, yogurt, spezie, spezie, olio extravergine di oliva, olio di caffè, caffè e thé.
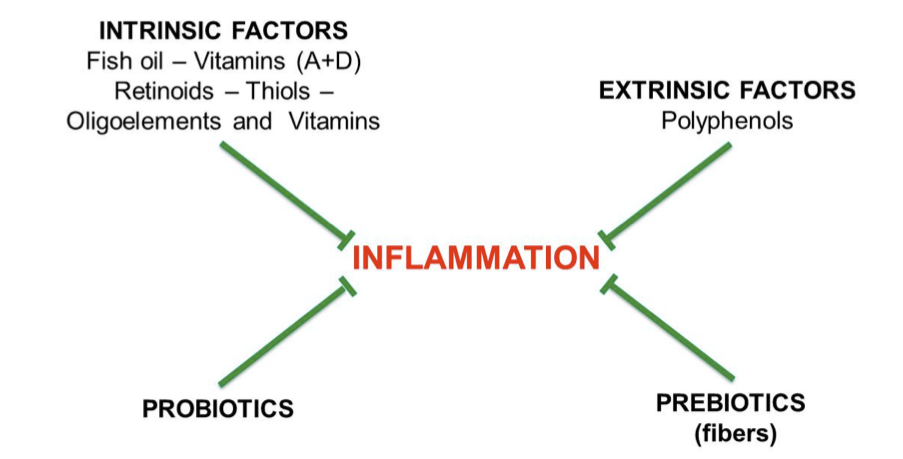
Figura 4. Fattori dietetici antinfiammatori. I fattori intrinseci sono quelli che svolgono un ruolo nel nostro metabolismo. Includono: omega-3 (PUFA n-3), presenti nell’olio di pesce; vitamine A e D, B12, PP, E e C; oligoelementi come magnesio, zinco e selenio; vitamine A e D, B12, PP, E e C; oligoelementi come magnesio, zinco e selenio; presenti nel metabolismo tiolico. acidi come: acido alfa-lipoico omega-3 (ALA), N-acetil cisteina polinsaturi a catena lunga e glutatione. acidi grassi I fattori estrinseci sono oligoelementi come magnesio, zinco e selenio; l’olio di pesce; polifenoli, vitamine A e fitochimici D, B12, PP, E e C presenti nelle verdure: hanno proprietà antinfiammatorie e regolano positivamente il catabolismo, ma sono riconosciuti dal nostro metabolismo come molecole “estranee”. Tuttavia, come mostrato di seguito, rappresentano una fonte di cibo per il microbiota intestinale. Prebiotici e probiotici sono citati qui per la loro azione antinfiammatoria, ma i loro effetti si esercitano principalmente attraverso il microbiota intestinale.
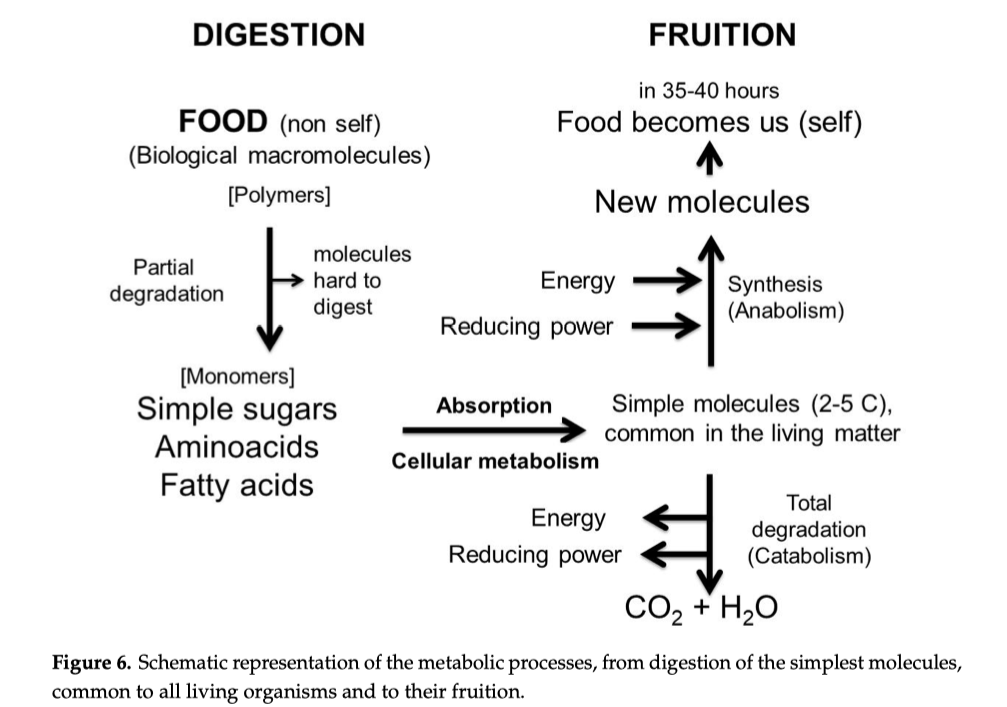
7. Cos’è il cibo e perché deve essere digerito
Essendo di origine diversa dalla nostra, tessuti, cellule e proteine del cibo non possono essere utilizzati così come sono, devono essere degradati in molecole semplici dall’apparato digerente nel tratto gastrointestinale (il recipiente di reazione) e poi assorbiti. Ecco perché il cibo deve essere digerito prima di essere assorbito: è non-self prima della digestione e diventa self quando la digestione è completa. Solo le molecole completamente digerite ci sono congeniali, sono riconosciute come self e possono entrare nel nostro metabolismo dopo il loro asorbimento.
11.3 Vitamine
È stato recentemente dimostrato che la vitamina A migliora l’integrità della barriera intestinale, anche in presenza di infiammazione intestinale e livelli elevati di LPS. Sembra contrastare l’azione dell’LPS e aumentare l’espressione delle proteine delle giunzioni strette [78].
Tuttavia, la vitamina A non è sufficiente. Come riportato nella nostra precedente revisione [25], la vitamina A e la vitamina D hanno effetti antinfiammatori sinergici e dovrebbero essere somministrate insieme. Ciò non sorprende, poiché entrambe sono liposolubili e spesso presenti insieme nello stesso alimento. I loro recettori nucleari cooperano se entrambe le vitamine si legano a loro. Le funzioni condivise della vitamina A e della vitamina D includono il potenziamento delle proteine delle giunzioni strette, la soppressione di IFN-γ e IL-17 e l'induzione delle cellule T regolatorie (Treg) [79]. Infine, le vitamine A e D sono efficaci contro l'infiammazione cronica e favoriscono la stabilità della barriera intestinale. La loro azione sul microbiota non è diretta poiché i loro recettori nucleari sono espressi solo dall'ospite, non dal microbiota. La carenza di vitamina D porta alla rottura della barriera intestinale, alla disbiosi intestinale e all'infiammazione intestinale [80].
In sintesi vitamina A e D:
-
rafforzano le giunzioni strette
-
sopprimono IFN-γ e IL-17
-
inducono Treg
-
contrastano infiammazione cronica
La carenza di vitamina D è associata a:
-
disbiosi
-
aumento permeabilità
-
infiammazione intestinale
12. Dalla disbiosi intestinale alla rottura della barriera emato-encefalica e all’infiammazione cerebrale
Il microbiota intestinale e le molecole di cibo non digerito cooperano nell'attacco alla barriera emato-encefalica. A prima vista, può sembrare strano che una condizione disbiotica intestinale possa portare al danno della barriera emato-encefalica (BEE). Tuttavia, nel corso di una disbiosi intestinale protratta, il normale dialogo tra intestino e SNC (central nervous system) [86–88] viene in qualche modo interrotto dalle molecole che fuoriescono dal lume intestinale e si riversano nel flusso sanguigno, innescando un'infiammazione sistemica cronica. La formazione di anticorpi contro le molecole di cibo non digerito, che assomigliano ad alcune proteine cerebrali, può indirizzare i processi pro-infiammatori verso la BEE e causarne la rottura. Infatti, ciò che è stato in grado di rendere la barriera intestinale più permeabile può avere lo stesso effetto anche sulla BEE. La sede della barriera ematoencefalica (BEE) sono i capillari cerebrali. Le loro cellule endoteliali sono fuse tra loro dalle giunzioni strette tra le proteie claudine, occludina e zona occludente, come nella barriera intestinale. Pertanto, il passaggio di molecole e cellule tra il sangue e il cervello è assolutamente limitato. In condizioni normali, solo le molecole idrofobiche e quelle dotate di un sistema di trasporto specifico (ad esempio, D-glucosio e amminoacidi essenziali) possono attraversare la BEE. Una differenza importante tra la BEE e la barriera intestinale è che la BEE è circondata dagli pseudopodi (le proiezioni della membrana) degli astrociti. La persistenza di molecole e cellule derivate dall'intestino in prossimità della barriera emato-encefalica può causarne la degradazione [89].
In sintesi la disbiosi intestinale cronica può:
-
generare infiammazione sistemica
-
produrre anticorpi contro antigeni alimentari
-
favorire mimetismo molecolare
-
contribuire alla rottura della barriera emato-encefalica
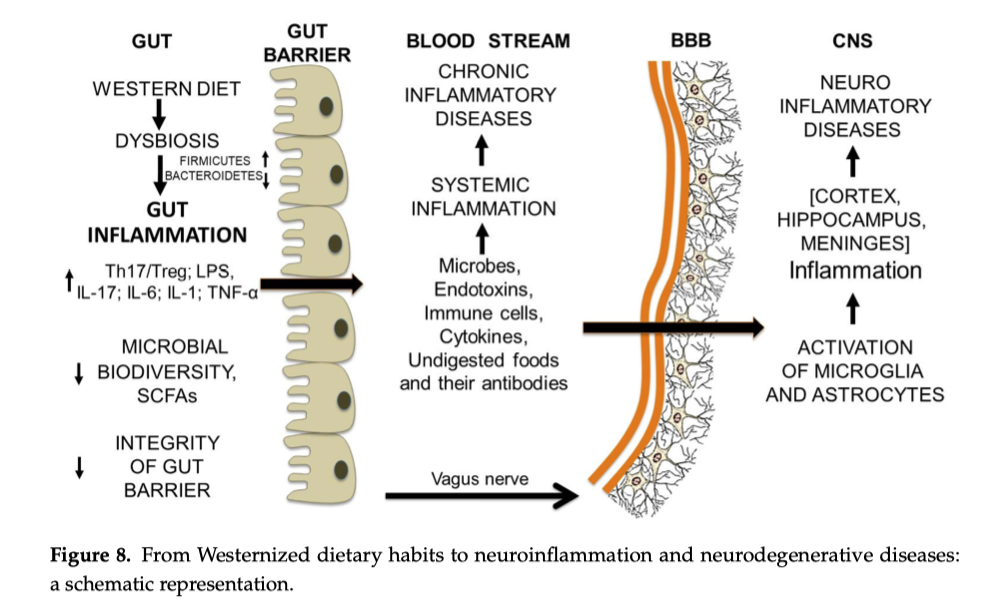
La BBB è costituita da cellule endoteliali unite da tight junctions e supportate dagli astrociti.
13. Conclusioni
Il percorso che porta alla malattia coinvolge il microbiota e frammenti di cibo non digerito, oltre a richiedere l’interruzione della barriera intestinale e della barriera emato-encefalica. La sequenza suggerita degli eventi è la seguente: (1) diete pro-infiammatorie protratte nel tempo, modificano la composizione del microbiota intestinale e inducono disbiosi del microbiota intestinale; (2) il sistema immunitario viene attivato e l’infiammazione intestinale aumenta, i livelli di cellule T e LPS aumentano; (3) la barriera intestinale diventa permeabile e il contenuto luminale (microbi, molecole di cibo non digerito, endotossine, cellule T e citochine) fuoriesce e innesca un’infiammazione sistemica cronica; (4) la risposta immunitaria contro frammenti di cibo non digerito che assomigliano a molecole cerebrali indirizza le molecole pro-infiammatorie alla BBB e ne provoca la rottura; (5) il passaggio attraverso la BBB di cellule e molecole pro-infiammatorie attivate provoca l’attivazione di cellule microgliali e astrociti (Le cellule microgliali sono le cellule immunitarie del cervello, mentre gli astrociti supportano i neuroni e contribuiscono alla barriera emato-encefalica ) e l’insorgenza di processi infiammatori in diverse aree cerebrali.
Nel presente articolo evidenziamo il possibile ruolo dei frammenti di cibo non digerito come agenti pro-infiammatori e l’importanza dell’integrità delle due barriere, intestinale e della barriera emato-encefalica (BEE), per la salute umana. Se la barriera intestinale diventa permeabile, frammenti di cibo non digerito fuoriescono anche dallo spazio luminale (intestino) insieme a batteri, endotossine, molecole immunocompetenti e cellule. Tutto questo materiale, che si supponeva rimanesse segregato nell’intestino, è ora in circolazione. Di solito ci preoccupiamo della disseminazione batterica, ma la disseminazione di cibo non digerito che attraversa la barriera intestinale e entra nel flusso sanguigno non deve essere trascurata.
Nell’intestino, i peptidi non completamente digeriti, sebbene ancora diversi da noi (non-self), erano sulla buona strada per diventare simili a noi (self), quindi la loro probabilità di mimetismo molecolare con i nostri peptidi potrebbe aumentare dopo una digestione parziale. Nel corso della disbiosi intestinale e dell’infiammazione intestinale, i linfociti T vengono attivati. Con l’attivazione dei linfociti T, i linfociti B vengono attivati per produrre anticorpi. Questi anticorpi contro gli antigeni alimentari possono riconoscere gli autoantigeni e innescare una risposta autoimmune. Ad esempio, è stato suggerito che gli anticorpi contro le proteine del grano e del latte nei donatori di sangue possano contribuire alle attività neuroimmuni [39].
Pertanto, i peptidi ( di aminoacidi) non digeriti e i loro anticorpi possono rafforzare le attività infiammatorie e autoimmuni e possono indirizzarle verso uno dei diversi organi, ma è necessaria la cooperazione con il microbiota.
Sequenza proposta:
-
Dieta pro-infiammatoria → disbiosi
-
Attivazione immunitaria → infiammazione intestinale
-
Permeabilità intestinale → infiammazione sistemica
-
Risposta autoimmune contro antigeni alimentari
-
Rottura BBB → neuroinfiammazione
Il cibo non digerito, insieme al microbiota disbiotico, può contribuire a processi infiammatori sistemici e autoimmuni.

