(approfondimento 1 di Potenziale genetico e condizioni di processo nella determinazione della forza del glutine, della digeribilità e dell’immunogenicità)
Il glutine è una rete proteica che emerge quando gliadine e glutenine vengono idratate e messe sotto energia meccanica (impasto) o termica (riscaldamento). La sua “forza” (tenacità/elasticità e capacità di sostenere stress) dipende da due famiglie di interazioni:
1 -Legami covalenti disolfuro (S–S).
Rappresentano i cross-link più stabili e strutturali della rete. Nelle glutenine, in particolare nelle subunità ad alto e basso peso molecolare (HMW-GS e LMW-GS), i ponti disolfuro intermolecolari consentono l’assemblaggio di lunghi polimeri proteici, spesso indicati come glutenin macropolymer (GMP). Questo impalcato polimerico costituisce la vera ossatura elastica del glutine e ne determina in larga misura la resistenza meccanica e la capacità di accumulare energia elastica durante la deformazione.
2 -Interazioni non covalenti (idrofobiche, legami a idrogeno, ioniche).
Sono singolarmente più deboli dei legami covalenti, ma estremamente numerose e dinamiche. Queste interazioni governano l’associazione laterale tra catene, la compattazione locale delle proteine e l’organizzazione della rete su scala fine. In pratica, non “costruiscono” l’impalcatura principale, ma ne modulano la densità, la flessibilità e la capacità di riorganizzarsi in risposta a variazioni di idratazione, temperatura, pH e forza meccanica. Numerosi studi mostrano che modifiche della struttura secondaria (α-eliche, β-foglietti) e delle interazioni non covalenti accompagnano — e in alcuni casi amplificano — gli effetti prodotti dai legami disolfuro.
Un punto chiave:
La rete del glutine non è statica. Durante l’impastamento e le successive lavorazioni avvengono reazioni di scambio tiolo–disolfuro (–SH/–S–S–) che consentono una continua riorganizzazione dei collegamenti tra catene proteiche. Questo rimodellamento permette alla rete di adattarsi allo stress, riparare connessioni danneggiate e, entro certi limiti, aumentare la propria coesione. In generale, una maggiore disponibilità di gruppi reattivi e una più efficiente riorganizzazione dei ponti S–S sono associate a una rete tendenzialmente più forte, più resiliente e meglio bilanciata tra estensibilità ed elasticità.
Implicazioni pratiche per l’impasto
Dal punto di vista operativo, la forza del glutine non dipende solo dal potenziale genetico della farina, ma anche da come il sistema viene “messo nelle condizioni” di esprimere e organizzare i propri legami intermolecolari.
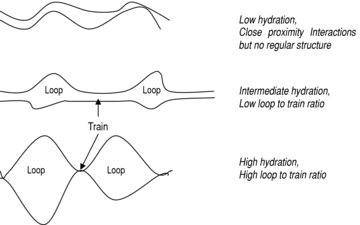
Idratazione adeguata: l’acqua agisce come plastificante e consente alle proteine di muoversi, interagire e riallinearsi. Idratazioni troppo basse limitano la formazione della rete; idratazioni più elevate favoriscono la mobilità molecolare e la riorganizzazione dei legami, rendendo il glutine più estensibile.
Energia di impasto: l’azione meccanica facilita il contatto tra catene proteiche e accelera le reazioni di scambio tiolo–disolfuro. Un impasto insufficiente porta a una rete incompleta; un eccesso di energia può invece causare rottura e riorganizzazione eccessiva dei legami, con perdita di struttura.
Tempo di riposo: fasi di riposo (autolisi, puntata) permettono alle interazioni non covalenti e ai disolfuri di redistribuirsi verso configurazioni più stabili, migliorando equilibrio tra elasticità ed estensibilità.
Condizioni chimiche: pH, sali e presenza di agenti ossidanti o riducenti influenzano direttamente l’equilibrio tra gruppi –SH e ponti –S–S–, modulando la densità di cross-link nella rete.
In sintesi, le pratiche di impasto non creano nuove proteine, ma determinano quanto efficacemente i legami intermolecolari disponibili vengono organizzati, traducendo il potenziale della farina in proprietà reologiche osservabili.