L’intestino: la centrale operativa dell’organismo
Ruolo della bocca
La digestione inizia nella bocca, dove avviene il primo livello di selezione e preparazione del cibo. Due funzioni sono particolarmente rilevanti.
La masticazione frammenta meccanicamente gli alimenti, aumentando la superficie di contatto e facilitando l’azione degli enzimi digestivi nelle fasi successive. Una masticazione lenta ed efficace non è un dettaglio secondario: determina la qualità del bolo alimentare che raggiungerà lo stomaco e condiziona l’efficienza dell’intero processo digestivo.
Parallelamente, la saliva avvia una prima trasformazione chimica. L’enzima ptialina (amilasi salivare) inizia la parziale idrolisi dei carboidrati complessi, scindendo l’amido in molecole più semplici. Anche se questa azione prosegue solo finché il pH rimane compatibile (prima dell’ambiente acido gastrico), rappresenta il primo passo verso la riduzione del cibo a componenti assorbibili.
La saliva svolge inoltre un ruolo protettivo: contiene immunoglobuline (come le IgA secretorie), enzimi antimicrobici e molecole ad azione tampone che contribuiscono a modulare la carica microbica ingerita. In questo senso, la bocca non è soltanto un “trituratore”, ma il primo filtro biologico che inizia a orientare l’interazione tra alimento, microbiota e sistema immunitario. La bocca ospita un microbiota orale. Se c’è disbiosi orale, parodontite, infezioni croniche alcuni batteri possono essere deglutiti, modificare il microbiota intestinale, influenzare l’infiammazione sistemica.
Un’infiammazione cronica orale può contribuire a:
-
Attivazione del sistema immunitario
-
Produzione di citochine
-
Alterazione delle tight junction intestinali
E questo può contribuire alla cosiddetta: iperpermeabilità intestinale.
Il filtro dello stomaco
Prima che l’intestino entri in gioco, il primo grande “laboratorio chimico” è lo stomaco. Qui l’acido cloridrico denatura le proteine e attiva la pepsina, iniziando la loro frammentazione in peptidi più piccoli. Questo passaggio non serve solo alla digestione: rappresenta anche una prima forma di selezione biologica. Un ambiente acido efficiente riduce la carica microbica ingerita e limita la quantità di frammenti proteici complessi che raggiungono l’intestino tenue.
L’intestino come sistema regolatore
Quando la funzione gastrica è ridotta — per esempio in presenza di ipocloridria, uso cronico di farmaci antiacidi o alterazioni della motilità — il tenue può ricevere una quota maggiore di materiale solo parzialmente digerito. Non è automaticamente una condizione patologica, ma può modificare l’interazione tra contenuto luminale, microbiota e sistema immunitario.
La digestione, oltre alla sua funzione nutritiva, agisce come un vero filtro biologico: decide che cosa può entrare nel corpo e che cosa deve restare nel lume intestinale fino all’eliminazione. Quando questo filtro—la barriera intestinale—perde efficienza, frammenti di cibo non completamente digerito e componenti microbiche possono oltrepassare il confine previsto e contribuire ad attivare risposte immunitarie e infiammatorie che, in alcuni casi, non restano confinate all’intestino.¹
L’ipotesi generale è chiara: prima della digestione completa, il cibo è materiale “non-self” (estraneo). Solo quando viene ridotto a molecole semplici (amminoacidi, monosaccaridi, acidi grassi) può essere assorbito in modo fisiologico e integrato nel metabolismo. Se invece attraversano la barriera peptidi o frammenti parzialmente digeriti, aumenta la probabilità di una risposta immunitaria indesiderata.¹
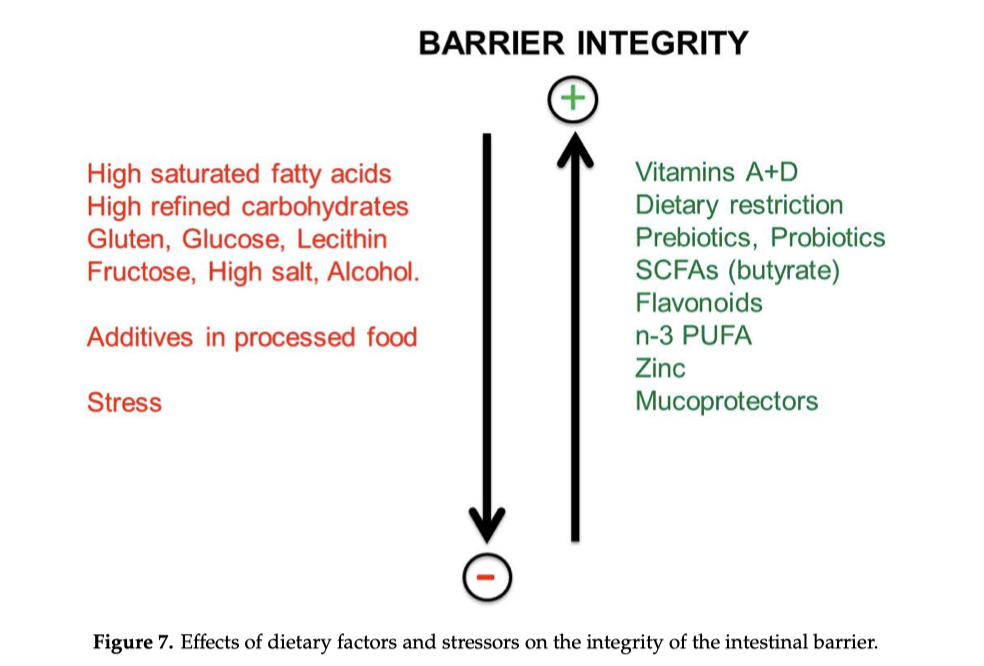
Un confine dinamico, non un “muro”: come funziona la barriera intestinale
La barriera intestinale è fatta di più livelli: muco, cellule epiteliali, e comparto vascolare sottostante. Ma il punto più delicato è nella “chiusura lampo” tra le cellule epiteliali: le giunzioni strette (tight junctions), proteine come claudine e occludina che regolano la permeabilità tra una cellula e l’altra. Queste strutture non sono fisse: si aprono o si chiudono in risposta a segnali nutrizionali, microbici e immunitari.²
Tra i regolatori più discussi c’è la zonulina*, associata alla modulazione delle tight junctions e quindi alla permeabilità.²
Perché la permeabilità conta: l’infiammazione può partire dall’intestino
Quando la barriera è compromessa, possono aumentare i passaggi (diretti o indiretti) di:
-
componenti microbiche (es. lipopolisaccaride/LPS),
-
frammenti alimentari parzialmente digeriti,
-
mediatori immunitari prodotti localmente.
Questo può favorire una condizione descritta come infiammazione cronica di basso grado, con effetti potenzialmente sistemici.¹
È fondamentale però distinguere tra:
-
meccanismi biologici plausibili e documentati, e
-
prove cliniche definitive (cioè dimostrazioni causali robuste nell’uomo, in popolazioni ampie e ben controllate).
Su molti passaggi della “catena” (dieta → microbiota → permeabilità → malattia) le evidenze nell’uomo restano spesso associative e influenzate da fattori confondenti (genetica, farmaci, stress, infezioni, età, comorbidità).¹
Glutine, gliadina e zonulina
Nel caso del glutine, la letteratura mostra che la gliadina (una frazione del glutine) può attivare vie biologiche collegate alla zonulina e a cambiamenti della permeabilità, con evidenze particolarmente convincenti nel contesto della celiachia e, in modo più variabile, in sottogruppi di persone con sensibilità al glutine non celiaca.⁴⁵ Non è, invece, dimostrato in modo definitivo che il glutine aumenti la permeabilità in modo clinicamente rilevante in tutti i soggetti sani.
“Infine va evidenziato che la misurazione della “zonulina” non è sempre lineare: alcuni lavori hanno mostrato che diversi kit ELISA commerciali utilizzati per misurarla possono riconoscere altre proteine, rendendo quel dato un biomarcatore da interpretare con cautela.⁶³ Oltre alla zonulina, la ricerca utilizza diversi marcatori indiretti di permeabilità intestinale — tra cui il test lattulosio/mannitolo, LPS, LBP e calprotectina fecale — ma nessuno di essi, isolatamente, rappresenta un indicatore definitivo. La valutazione rimane complessa e integrata.”
Alcol: l’effetto intestinale oltre il fegato
L’assunzione cronica di alcol è associata a disbiosi e alterazioni della barriera. In modelli sperimentali emergono meccanismi che includono la riduzione di difese antimicrobiche intestinali (come lectine della famiglia REG3) e un aumento della probabilità di traslocazione batterica, con conseguente attivazione infiammatoria.⁷
Additivi e ultra-processati
Alcuni additivi presenti negli alimenti ultra-processati (per esempio certi emulsionanti) hanno mostrato in modelli animali la capacità di alterare il microbiota, ridurre la protezione del muco e favorire segnali di infiammazione/metabolismo alterato.⁸
Anche alcuni dolcificanti non calorici sono stati collegati, in studi molto citati, a modifiche del microbiota e a variazioni metaboliche in modelli sperimentali. Tuttavia, pur esistendo dati rilevanti che giustificano attenzione verso l’eccesso di ultra-processati, non vi sono evidenze che l’effetto sia certo e uguale per tutti.⁸⁹
Disbiosi, LPS e immunità: il ruolo del microbiota come “interruttore” infiammatorio
La disbiosi viene spesso descritta come:
-
riduzione della biodiversità microbica,
-
alterazioni funzionali (es. produzione di SCFA come il butirrato),
-
aumento di segnali pro-infiammatori (tra cui LPS) e cambiamenti dell’equilibrio immunitario.
In questo scenario, il passaggio di LPS nel sangue (endotossiemia metabolica) è una delle ipotesi che collegano intestino e infiammazione sistemica.¹
Allo stesso tempo, la relazione è bidirezionale: la malattia può modificare il microbiota tanto quanto il microbiota può influenzare la malattia.¹
Dalla pancia al cervello: asse intestino–cervello e barriera emato-encefalica
L’idea che infiammazione intestinale e disbiosi possano “parlare” al sistema nervoso è oggi ben presente nella ricerca. Una delle ipotesi discusse è che l’infiammazione sistemica cronica e la produzione di anticorpi contro antigeni alimentari (con possibili fenomeni di mimetismo molecolare) possano contribuire a stressare anche la barriera emato-encefalica, che condivide l’uso di tight junctions come sistema di sigillo.¹
Qui la prudenza è obbligatoria: la letteratura contiene numerosi lavori meccanicistici e osservazionali, ma nei soggetti sani non esistono prove cliniche definitive che colleghino in modo diretto e causale glutine/permeabilità intestinale a rottura della barriera emato-encefalica e neurodegenerazione.¹
In sintesi il quadro che emerge è questo:
-
L’intestino non è solo digestione: è un organo immunologico e di barriera.¹²
-
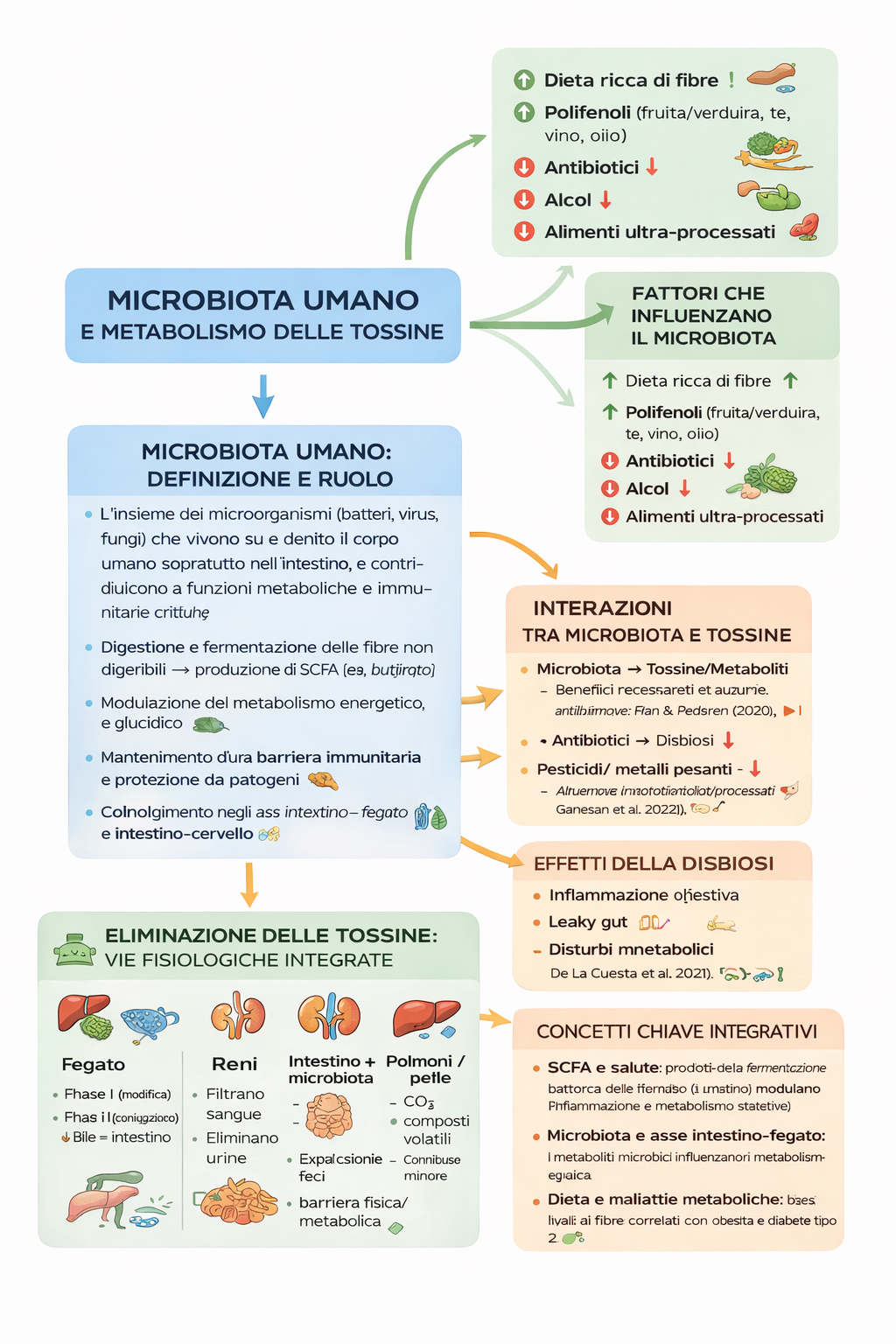
Dieta e stile di vita possono spostare l’equilibrio del microbiota verso eubiosi o disbiosi, con possibili effetti su infiammazione e permeabilità.¹
-
Alcuni trigger (glutine nella celiachia, alcol cronico, diete ricche di ultra-processati) hanno basi biologiche e dati consistenti in specifici contesti.⁴⁵⁷⁸
-
La parte più delicata della divulgazione riguarda la misura e l’interpretazione: biomarcatori come la “zonulina” non sono sempre affidabili in modo diretto e universale, e molte associazioni nell’uomo non equivalgono a causalità.³⁶
Nota finale conclusiva
Le evidenze scientifiche attuali indicano che l’intestino non è soltanto un organo digestivo, ma un centro regolatore cruciale dell’equilibrio immunitario, metabolico e neurobiologico. Attraverso il microbiota e la barriera mucosale, esso dialoga costantemente con il sistema immunitario e con il sistema nervoso centrale, configurando il cosiddetto asse intestino–sistema immunitario–cervello.
Quando questo asse è in equilibrio, contribuisce alla regolazione della tolleranza immunitaria e al mantenimento dell’omeostasi infiammatoria. Quando invece si altera — per disbiosi, aumento della permeabilità intestinale o stimoli alimentari pro-infiammatori — può instaurarsi uno stato di attivazione immunitaria cronica di basso grado che, nel tempo, si riflette non solo sul metabolismo ma anche sulla funzione neurologica.
In questo contesto, l’alimentazione assume un ruolo centrale. Non è un fattore neutro. Può sostenere la resilienza dell’asse intestino–immunità–cervello oppure contribuire alla sua destabilizzazione, soprattutto nei soggetti con predisposizioni genetiche, fragilità metaboliche, patologie infiammatorie o condizioni di salute già compromesse.
Per questo motivo, nei soggetti con predisposizioni genetiche o condizioni cliniche già presenti, un criterio di prudenza nutrizionale non rappresenta un eccesso di cautela, ma un atto di responsabilità preventiva. La qualità dell’alimentazione quotidiana non influisce solo sull’intestino: influenza il tono immunitario, il livello infiammatorio di fondo e, indirettamente, anche la salute cerebrale. Prendersi cura dell’intestino significa, in larga misura, prendersi cura dell’intero organismo.
Richiami:
*La zonulina La zonulina è una proteina prodotta dalla mucosa intestinale che modula le “giunzioni strette” (tight junctions) tra gli enterociti, contribuendo alla regolazione della permeabilità intestinale. Un aumento dei suoi livelli — rilevabile nel sangue o nelle feci — è stato associato a una possibile alterazione della barriera intestinale (“leaky gut”). Tuttavia, la misurazione della zonulina presenta ancora limiti metodologici: alcuni test attualmente in uso potrebbero non quantificare in modo specifico la molecola biologicamente attiva. Per questo motivo, la zonulina è considerata un indicatore indiretto e da interpretare con cautela.
Bibliografia
-
Undigested Food and Gut Microbiota May Cooperate in the Pathogenesis of Neuroinflammatory Diseases: A Matter of Barriers and a Proposal on the Origin of Organ Specificity — 2019, Riccio P.; Rossano R.
-
Intestinal permeability and its regulation by zonulin: diagnostic and therapeutic implications — 2012, Fasano A.
-
Blurring the picture in leaky gut research: how shortcomings of zonulin as a biomarker mislead the field of intestinal permeability — 2021, Massier L.; Chakaroun R.; Kovacs P.; Heiker J.T.
-
Gliadin, zonulin and gut permeability: effects on celiac and non-celiac intestinal mucosa and intestinal cell lines — 2006, Drago S. et al.
-
Gliadin induces an increase in intestinal permeability and zonulin release by binding to the chemokine receptor CXCR3 — 2008, Lammers K.M. et al.
-
Widely Used Commercial ELISA Does Not Detect Precursor of Haptoglobin2, but Recognizes Properdin as a Potential Second Member of the Zonulin Family — 2019, Ajamian M. et al.
-
Intestinal REG3 Lectins Protect against Alcoholic Steatohepatitis by Reducing Mucosa-Associated Microbiota and Preventing Bacterial Translocation — 2016, Wang L. et al.
-
Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome — 2015, Chassaing B. et al.
-
Artificial sweeteners induce glucose intolerance by altering the gut microbiota — 2014, Suez J. et al.