Microbiota intestinale e infiammazione
In evidenza:
“Ruolo del microbiota intestinale nell’immunità e nell’infiammazione
I microbi possiedono una varietà di funzioni che influenzano la loro capacità di crescere e colonizzare, determinando al tempo stesso effetti a valle per l’ospite che possono essere benefici o meno [61]. Gli esseri umani non sono in grado di digerire alcuni componenti delle fibre alimentari a causa della mancanza degli enzimi necessari per scomporre e sfruttare l’energia di questi carboidrati [62]. Alcune specie di microbi producono enzimi specifici che consentono la fermentazione dei nutrienti in forme assorbibili, compresa quella dei carboidrati indigeribili in acidi grassi a catena corta (SCFA) [62,63]. Questi SCFA possono avere effetti antinfiammatori e immunomodulatori [63]. Gli SCFA rappresentano solo una piccola parte del quadro più ampio poiché, oltre agli enzimi e ad altri metaboliti prodotti, anche i componenti dei batteri stessi, inclusi lipopolisaccaridi, carboidrati delle capsule cellulari e altre endotossine, possono essere rilasciati e provocare effetti secondari sull’ospite. Questi effetti includono il mantenimento dell’epitelio intestinale (e quindi l’integrità della parete intestinale), la produzione di vitamine e le interazioni con diverse molecole e cellule chiave di segnalazione del sistema immunitario, attivando e inibendo risposte specifiche [1]. Oltre al metabolismo dei nutrienti, i microrganismi intestinali influenzano aspetti della farmacocinetica poiché svolgono il metabolismo dei farmaci [64]. Forniscono una difesa naturale contro le specie patogene attraverso la competizione e il mantenimento della mucosa. È attraverso il loro contatto con il sistema immunitario che i microrganismi che occupano l’intestino possono provocare o prevenire l’infiammazione. Possono essere associati a meccanismi antinfiammatori, stimolando le cellule regolatrici del sistema immunitario a inibire l’infiammazione [65]. D’altra parte, poiché i batteri regolano la permeabilità dell’intestino, alcune specie possono favorire un “intestino permeabile”, in cui i metaboliti associati ai microbi lasciano l’intestino ed entrano nel flusso sanguigno. In risposta, il corpo produce citochine e altri mediatori, lanciando di fatto una risposta infiammatoria [66]. Allo stesso modo, le cellule all’interno del tessuto epiteliale dell’intestino forniscono metaboliti batterici alle cellule immunitarie, promuovendo l’infiammazione sia su scala locale che sistemica. La persistenza di questa condizione può portare a un’infiammazione subacuta o cronica, che può successivamente portare allo sviluppo di malattie come malattie infiammatorie intestinali, diabete o malattie cardiovascolari [65].”
Lo studio completo
“Riassunto: Il microbiota intestinale comprende una comunità diversificata di batteri che svolgono varie funzioni che influenzano la salute generale dell’ospite. Questi comprendono il metabolismo dei nutrienti, la regolazione del sistema immunitario e la difesa naturale contro le infezioni. La presenza di alcuni batteri è associata a molecole infiammatorie che possono provocare infiammazioni in vari tessuti del corpo. L’infiammazione è alla base di molte condizioni croniche multisistemiche tra cui l’obesità, l’aterosclerosi, il diabete mellito di tipo 2 e le malattie infiammatorie intestinali. L’infiammazione può essere innescata da componenti strutturali dei batteri che possono provocare una cascata di percorsi infiammatori che coinvolgono interleuchine e altre citochine. Allo stesso modo, i sottoprodotti dei processi metabolici nei batteri, inclusi alcuni acidi grassi a catena corta, possono svolgere un ruolo nell’inibizione dei processi infiammatori. In questa recensione, abbiamo mirato a fornire una panoramica della relazione tra il microbiota intestinale e le molecole infiammatorie e ad evidenziare rilevanti lacune nelle conoscenze in questo campo. Sulla base della letteratura attuale, sembra che poiché la composizione del microbiota intestinale differisce da individuo a individuo ed è condizionata da una varietà di fattori come la dieta e la genetica, alcuni individui possono possedere batteri associati ad effetti pro-infiammatori mentre altri possono ospitare batteri con effetti anti-infiammatori. I recenti progressi tecnologici hanno consentito metodi migliori per caratterizzare il microbiota intestinale. Ulteriori ricerche per migliorare continuamente la nostra comprensione delle vie infiammatorie che interagiscono con i batteri potrebbero chiarire le ragioni dietro le diverse presentazioni della stessa malattia e le diverse risposte allo stesso trattamento in individui diversi. Inoltre, può informare la pratica clinica poiché i microbi antinfiammatori possono essere impiegati nelle terapie probiotiche o utilizzati per identificare terapie prebiotiche adeguate.
1. Introduzione
La comprensione della relazione simbiotica tra i batteri intestinali umani e il funzionamento complessivo del corpo si è notevolmente approfondita e ampliata, con un’accelerazione dei risultati della ricerca in quest’area. Mentre la ricerca iniziale esaminava generalmente la composizione del microbiota e la sua relazione con la presentazione della malattia, recentemente si è verificato uno spostamento più importante verso la comprensione dei meccanismi attraverso i quali la variazione del microbiota può portare alla manifestazione della malattia [1]. Chiarire questi meccanismi può contribuire allo sviluppo di nuove terapie e ottimizzare la pratica clinica. Inoltre, discernere la struttura e la funzione del microbiota diventa sempre più importante nell’era della medicina di precisione poiché ciò consente un trattamento personalizzato per migliorare i risultati clinici [2]. Questa recensione presenta una breve introduzione al microbiota intestinale, ai fattori influenti sul microbiota, alle tecniche di analisi del microbioma e all’interpretazione dei risultati
2. Cos’è il microbiota intestinale?
Il microbiota intestinale si riferisce ai microrganismi che popolano il tratto gastrointestinale umano. Questa comunità dinamica comprende prevalentemente specie del dominio procariotico (compresi batteri e altri microbi unicellulari privi di organelli specializzati) e, in misura minore, funghi, parassiti e archaea. Anche i virus sono costituenti di questo ambiente. Il profilo genetico e funzionale delle specie microbiche è chiamato microbioma intestinale [3]. A un livello più ampio, gli esseri umani possono essere classificati in base ai loro enterotipi, che sono composizioni microbiche intestinali nettamente simili che possono essere osservate in alcune popolazioni [4]. In un singolo individuo, è stato dimostrato che le specie microbiche intestinali che popolano collettivamente contengono 3,3 milioni di geni che, se confrontati con i circa 23.000 geni del genoma umano, dimostrano la vastità e il potenziale effetto di queste specie sulla salute umana [5]. Inoltre, il corpo umano contiene quasi tante cellule batteriche quante sono le cellule umane [6].
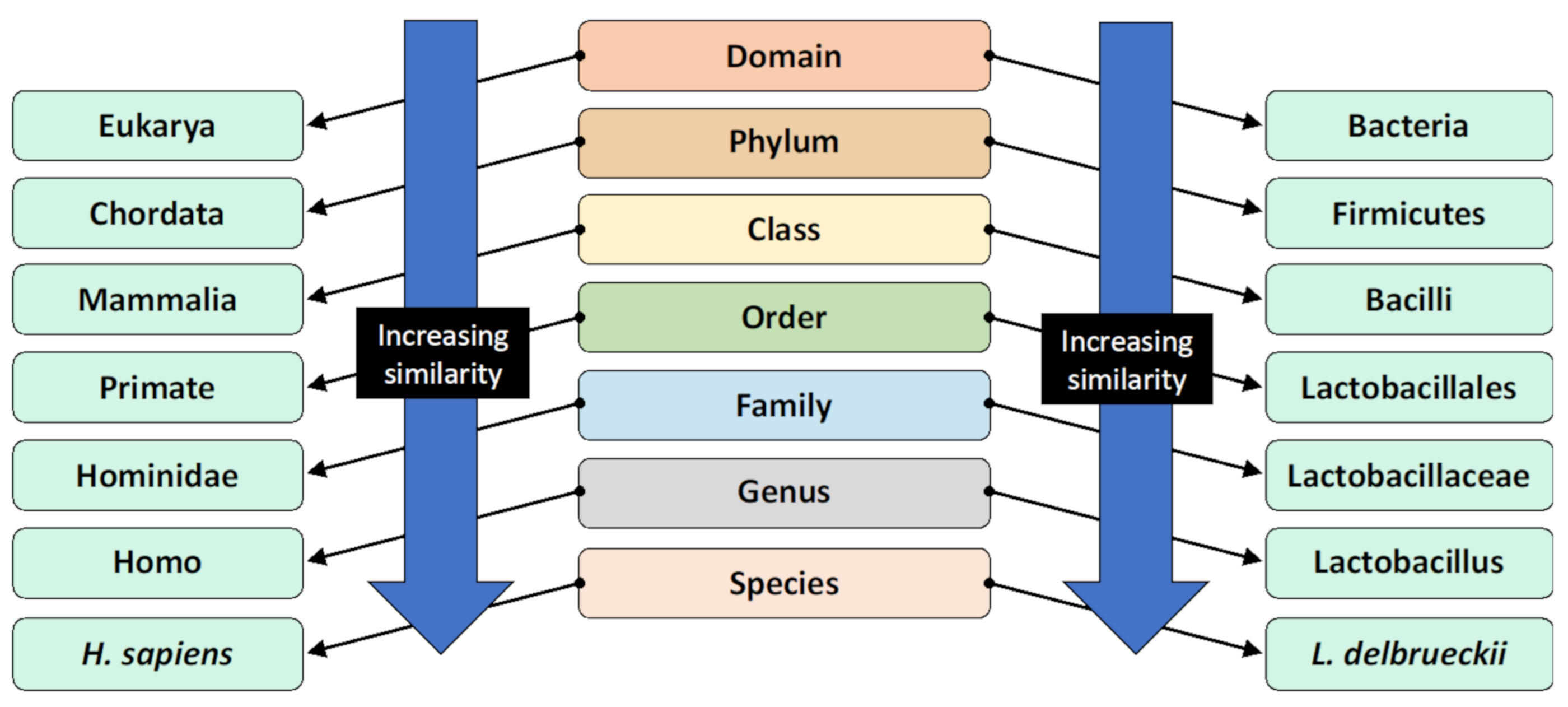
Figura 1. Il sistema di classificazione tassonomica e la classificazione degli esseri umani e Lactobacillus delbrueckii come esempio [8]. Gli organismi sono classificati secondo questo sistema gerarchico, dove il gruppo più generale e inclusivo si trova a livello di dominio. Gli organismi della stessa specie sono geneticamente molto simili.
3 – Metodi per studiare il microbiota intestinale
I ricercatori studiano il microbiota intestinale attraverso vari approcci ed è la combinazione di questi diversi metodi che consente una costruzione completa delle conoscenze che ruotano attorno al microbiota intestinale e alla salute. Negli studi sull’uomo, il metodo più consolidato per caratterizzare il microbioma intestinale è il campionamento delle feci poiché è facilmente disponibile, non invasivo e densamente popolato da microbi rappresentativi del microbiota intestinale luminale [9,10]. Dopo la raccolta, i campioni fecali vengono congelati e conservati immediatamente, generalmente a -80 ◦C [11]. Il DNA viene estratto dalle feci in due fasi principali. Innanzitutto, il campione viene purificato attraverso l’uso di più reagenti e la centrifugazione, consentendo di eliminare i microbi dagli altri componenti delle feci. La fase successiva prevede la lisi delle cellule batteriche mediante incubazione dei campioni con tampone di lisi con agitazione, come agitazione vigorosa con o senza sfere, ed esecuzione di un’ulteriore centrifugazione [12]. Successivamente, il DNA risultante viene amplificato utilizzando approcci come quello multipla amplificazione di spostamento [11]. Un primer rRNA 16S viene selezionato e utilizzato per il sequenziamento del gene. I dati della sequenza ottenuti vengono sottoposti a filtraggio per garantire il rispetto delle soglie di qualità. Successivamente, il conteggio delle sequenze viene normalizzato prima dell’analisi delle unità tassonomiche operative (OTU). Un algoritmo di clustering OTU viene applicato per identificare eneri e specie batteriche [11]. Il protocollo generale è riassunto nella Figura 2.
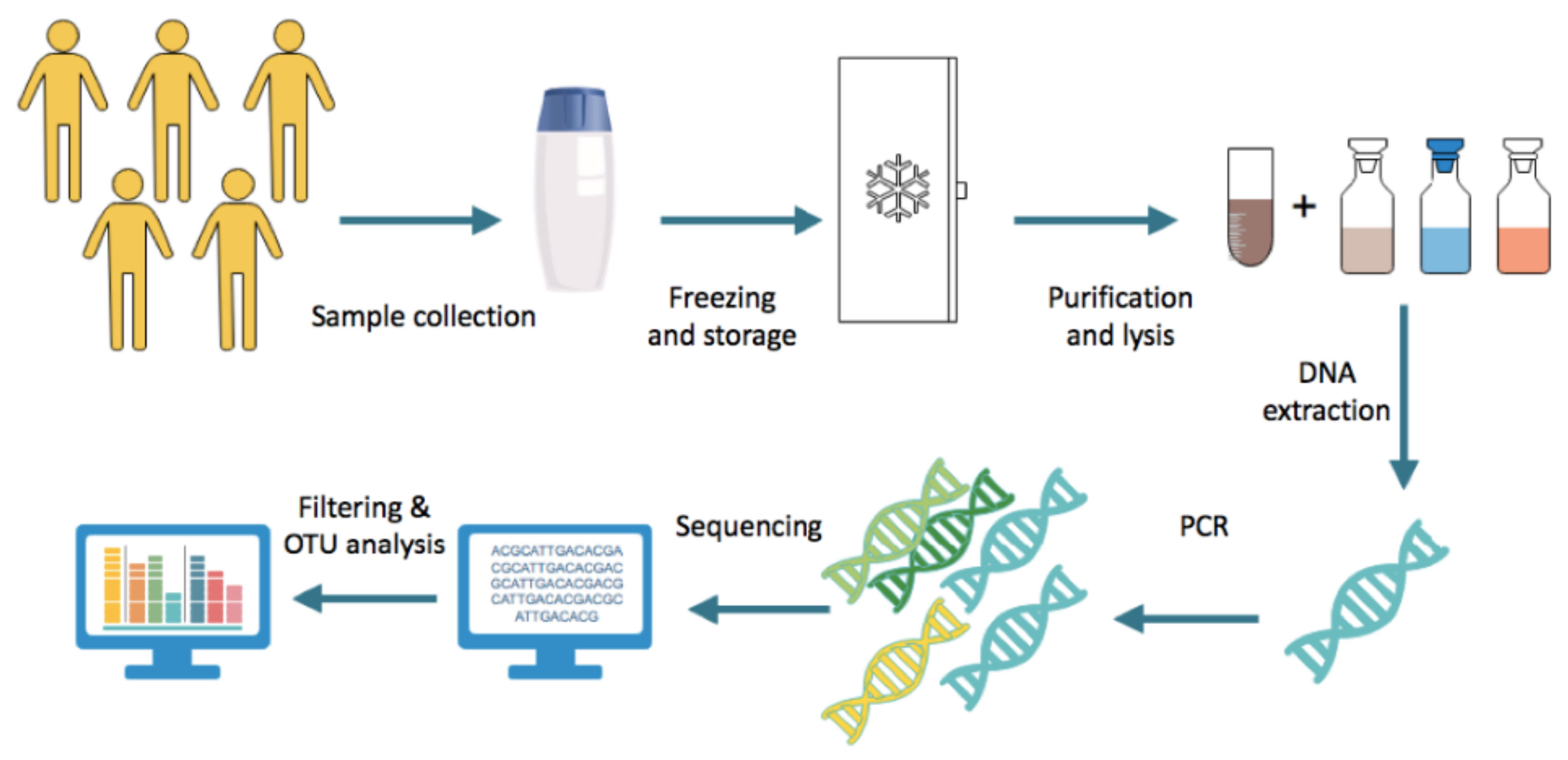
Figura 2. Passaggi generalmente eseguiti nell’analisi del microbioma delle feci.
La diversità microbica viene valutata secondo due parametri; diversità alfa e beta. La diversità alfa si riferisce alla variazione all’interno di un singolo campione, mentre la diversità beta si riferisce a quella tra campioni [13]. Questi sono generalmente determinati in ordine crescente di parentela, dal phylum al genere, sebbene alcuni studi utilizzino anche analisi a livello di specie [14]. Le piattaforme che facilitano queste analisi includono QIIME, uno strumento software gratuito che valuta le sequenze di rRNA 16S [13]. Tuttavia, l’utilizzo di questa classificazione di rango inferiore potrebbe produrre risultati inaffidabili; la maggior parte degli studi in genere valuta solo una porzione del gene 16S rRNA invece di esaminare l’intera lunghezza del gene [15]. Ciò compromette l’affidabilità della classificazione a livello di specie poiché una piccola porzione del gene può avere una capacità altamente variabile di rilevare le specie [15]. Poiché i reagenti utilizzati in queste fasi possono introdurre contaminanti, è importante testare la contaminazione con l’amplificazione del gene 16S rRNA e cancellare computazionalmente le sequenze delle specie contaminanti dalle sequenze complessive ottenute [11].
Un’istantanea più rappresentativa del microbiota intestinale può essere ottenuta attraverso il campionamento del tessuto della mucosa del tratto gastro-intestinale distale; tuttavia, questo metodo presenta varie limitazioni ed è quindi meno comunemente utilizzato nella ricerca [16]. Una di queste limitazioni è che, rispetto al campionamento delle feci, dove la contaminazione delle cellule umane è minima, l’analisi dei campioni bioptici del tessuto mucoso deve prendere in considerazione la presenza di cellule umane e materiale genetico poiché questi potrebbero interferire con i risultati [10]. Altri metodi meno utilizzati di routine includono il lavaggio e il campionamento con tampone, tuttavia, questi non sono stati ampiamente valutati in termini di coerenza del protocollo e di quanto rappresentativi siano i risultati della comunità microbica intestinale [17]. Gli studi che utilizzano modelli animali sono fondamentali e frequenti in quest’area di ricerca poiché consentono una comprensione più completa di alcuni aspetti del ruolo del microbiota intestinale nella salute. I fattori confondenti possono essere controllati in modo più efficace nei modelli animali, inclusi roditori, pesci e insetti, per comprendere meglio le variabili sperimentali, i loro effetti e le interazioni ospite-microbiota [10,18]. Ciò è particolarmente rilevante negli studi che cercano di esaminare i fattori che influenzano il microbiota intestinale o gli effetti dei microbi intestinali su tessuti o sistemi. Modelli animali privi di germi sono stati utilizzati per valutare il funzionamento indipendente dal microbiota rispetto ai normali modelli animali [19]. Inoltre, in questo campo di studio vengono utilizzati modelli gnotobiotici, in cui gli animali, tipicamente roditori, vengono preparati con specifici ceppi noti o combinazioni di batteri e sono spesso geneticamente modificati per determinare gli effetti a valle di determinati prodotti batterici o prodotti associati [20–24] . Tuttavia, i risultati degli studi sui modelli gnotobiotici devono essere interpretati con cautela poiché il sistema immunitario di questi animali è alterato fin dalle prime fasi dello sviluppo. Anche i sistemi di coltura cellulare sono importanti in questo caso poiché possono essere utilizzati per esaminare ulteriormente le interazioni controllate tra i microbi intestinali e altre variabili. Queste tecniche possono comportare la coltivazione di microbi nativi dell’intestino umano, di tessuti umani o di tessuti artificiali [10].
4. Fattori associati alla composizione del microbiota
Il microbiota intestinale nel tratto gastrointestinale (GI) si sviluppa durante l’infanzia. Il processo di colonizzazione microbica dipende da una varietà di fattori dell’ospite, descritti più dettagliatamente di seguito. Inoltre, diverse regioni del tratto gastrointestinale hanno diversi ambienti chimici che consentono ad alcuni microbi di prosperare più di altri. La diversità e la stabilità aumentano continuamente durante le prime fasi dello sviluppo, raggiungendo una certa composizione con l’età [25]. Questa composizione può essere modulata da vari fattori ed eventi della vita, che possono sinergizzare per determinare una maggiore diversità [1]. È importante notare che in questo caso una maggiore diversità è generalmente associata a migliori risultati di salute, sebbene siano stati riportati alcuni casi di maggiore diversità in alcuni stati patologici [26,27]. I fattori che influenzano l’ambiente intestinale contribuiranno a loro volta al caratteristico ecosistema microbico intestinale, dando così origine alla variazione interindividuale che osserviamo.
4.1. Modalità di consegna (da: the manner in which the Products are delivered to End Users) e alimentazione*
Le specie che partecipano alla colonizzazione iniziale del tratto gastrointestinale differiscono a seconda della modalità con cui nasce un neonato [28]. Sia il taglio cesareo che la modalità vaginale comportano esposizioni a microbi, tuttavia, si verificano differenze per quanto riguarda la fonte di questi microbi. Nei parti con parto vaginale, il neonato è esposto ai batteri vaginali materni e, pertanto, la composizione iniziale del microbiota tende a riflettere questa regione [29]. Più nello specifico questi batteri fanno parte dei generi Lactobacillus, Prevotella e Sneathia. Al contrario, i nati con taglio cesareo sono fortemente influenzati dalla flora cutanea materna e tendono ad avere microbioti meno diversificati [29,30]. In quanto tali, contengono una percentuale maggiore di microbi che vivono nella pelle, tra cui le specie Staphylococcus, Corynebacterium e Propionibacterium [29]. Inoltre, è stato dimostrato che l’uso di antibiotici intrapartum durante il taglio caseario influisce sul microbiota intestinale neonatale [31]. Nel complesso, è stato osservato un maggiore grado di somiglianza nel microbiota intestinale tra i neonati partoriti per via vaginale e le loro madri, rispetto ai bambini nati con cesareo [32]. Il ruolo del microbiota è fondamentale nello sviluppo del sistema immunitario, pertanto le differenze nel microbiota intestinale possono spiegare perché quest’ultima categoria ha un rischio maggiore di sviluppare infezioni o allergie [33,34]. Oltre alla modalità di parto, anche il tipo di latte consumato nei primi anni di vita influisce sul microbiota intestinale. Il latte materno differisce dal latte artificiale poiché contiene i propri batteri e diversi composti bioattivi e sostanze nutritive. Specie specifiche di batteri potrebbero essere più adatte per gli intestini ricchi dei loro nutrienti preferenziali, ad esempio le fibre alimentari, poiché sono in grado di estrarre la loro energia da questi [35]. Per questo motivo, le specie Bifidobacterium predominano nel microbiota degli individui allattati al seno, mentre le specie Enterobacteriaceae sono più frequenti nei neonati allattati con latte artificiale [30]. Inoltre, i bambini allattati con latte artificiale hanno un microbiota più diversificato rispetto ai loro coetanei allattati al seno, suggerendo che i benefici del latte materno potrebbero essere dovuti a fattori non correlati al microbiota intestinale [32]. È importante notare che la comunità microbica intestinale subisce molti cambiamenti durante la fase iniziale di sviluppo di un neonato e che gli effetti di fattori intrinseci ed estrinseci possono portare solo a cambiamenti strutturali temporanei ed effimeri [36].
*: il modo con cui i batteri arrivano al neonato (dalla vagina o dalla pelle)
4. Dieta
Il comportamento alimentare può far sì che alcuni ceppi dominino l’intestino più di altri e quindi specifiche caratteristiche fenotipiche a valle nell’ospite. Le modifiche alla dieta renderanno i diversi nutrienti più facilmente disponibili, cambiando di conseguenza i ceppi dominanti, contribuendo alla natura dinamica del microbiota [37]. È stato rivelato che gli individui che consumano più carne nella loro dieta hanno microbiomi intestinali significativamente diversi rispetto a quelli che seguono una dieta a predominanza vegetale, a causa del fatto che alcuni batteri prosperano in abbondanza di proteine, [38,39]. Ad esempio, le specie Bacteroides tendono a dominare il tratto gastrointestinale di coloro che consumano proteine animali e le specie Prevotella sono associate a diete a base vegetale [40]. Inoltre, l’effetto della dieta sul microbiota intestinale può essere visto negli studi etnografici, dove la cultura influenza i tipi generali di cibo consumato, e quindi gli enterotipi collettivi [41]. Ciò può essere osservato nelle popolazioni asiatiche che consumano un elevato consumo di alimenti ricchi di amido come il riso; gli enterotipi di queste popolazioni sono caratterizzati da un’abbondanza notevolmente elevata di Bifidobacterium, un genere noto per produrre grandi quantità di enzimi che metabolizzano l’amido [4]. La dieta occidentale, ricca di grassi saturi ma povera di grassi insaturi, è stata ampiamente studiata e si è rivelata positivamente associata a microrganismi anaerobici e generi specifici tra cui Bacteroides e Bilophila [42]. Oltre agli effetti di macro e micronutrienti specifici nella dieta umana sul microbiota intestinale, alcuni studi sugli animali hanno notato che gli additivi comunemente presenti nella dieta occidentale hanno associazioni con la composizione alterata del microbiota e il suo potenziale infiammatorio [43].
4.3. Età, sesso e indice di massa corporea
Sono state notate differenze nella composizione del microbiota rispetto all’età. In uno studio trasversale su 367 partecipanti sani in Giappone, sono stati osservati phyla simili nel microbioma intestinale in gruppi di età compresi tra 0 e 104 anni, sebbene in proporzioni diverse [44]. Una tendenza segnalata era un’associazione tra età e abbondanza di attinobatteri, dove un aumento dell’età era associato a una diminuzione dell’abbondanza. I microrganismi del phylum Firmicutes sono diventati abbondanti nel microbiota degli individui nella fase post-svezzamento, in particolare dopo i 4 anni, mentre l’inverso è stato osservato con la popolazione degli Actinobacteria. I batterioidetes hanno mantenuto un livello stabile di abbondanza tra i diversi gruppi di età, sebbene gli individui di età superiore ai 70 anni avessero livelli più elevati di questi microbi [44]. I modelli trovati in questo studio possono essere attribuiti ai vari eventi che si verificano nel corso della vita, tra cui varie esposizioni ambientali a microrganismi, insorgenza di malattie, cambiamenti ormonali e funzionamento del sistema immunitario, complicando così l’influenza dell’età sul microbiota intestinale [44 ,45]. Sebbene studiate molto meno di altri fattori, è stato notato che le differenze sessuali influenzano la composizione del microbiota [46]. Le differenze diventano più evidenti quando si studiano i microbi a livello di genere o di specie. In uno studio sperimentale di Baars et al. [47], sono state riscontrate differenze legate al sesso nel modo in cui il microbiota intestinale interagisce con l’ospite. Utilizzando i topi, hanno determinato che le differenze compositive e trascrizionali erano evidenti. A loro volta, questi hanno influenzato le differenze nel metabolismo dei lipidi osservate tra topi maschi e femmine. Haro et al. [48] hanno riscontrato che i Bacteroides caccae erano più abbondanti nelle femmine che nei maschi, mentre per la specie Bacterioides plebeius è stato osservato il contrario. È interessante notare che queste differenze sessuali sono correlate all’indice di massa corporea (BMI). Nello stesso studio di Haro et al. [48], la variazione del sesso diventava più evidente quando il BMI aumentava. Ad esempio, i maschi che superavano un BMI pari a 33 avevano un’abbondanza di Firmicutes inferiore rispetto a quelli con un BMI inferiore, tuttavia, questa tendenza non è stata osservata nelle femmine. Piuttosto, l’abbondanza di Firmicutes è rimasta elevata indipendentemente dal BMI nelle partecipanti di sesso femminile [48]. Si ipotizza che queste osservazioni siano dovute a differenze ormonali, tuttavia, è necessario condurre ulteriori ricerche per comprendere i meccanismi esatti [49]. In generale, è stata segnalata un’associazione con il BMI e la diversità batterica intestinale, con un modello che dimostra che un aumento del BMI è fortemente correlato con una diminuzione della diversità [50]. Inoltre, vi è una proporzione ridotta di membri del phylum Bacteroidetes rispetto ai Firmicutes nell’obesità e, con la perdita di peso, questo rapporto ritorna normale [51].
4.4. Genotipo ospite
Genotipi ospiti specifici sono associati a differenze nella diversità microbica intestinale, nonché a strutture specifiche della comunità [52]. Poiché i geni influenzano il funzionamento del sistema immunitario e la suscettibilità alle malattie, alcuni alleli sono associati a determinate composizioni. Ad esempio, gli individui con la variante rs651821 del gene APOA5 hanno maggiori probabilità di avere membri dei generi Lactobacillus, Sutterella e Methanobrevibacter nel loro microbiota, che di conseguenza si correla con un maggior rischio di disturbi metabolici [52]. In numerosi studi è stato dimostrato che varianti specifiche di geni associati al microbioma sono associate a condizioni tra cui obesità, schizofrenia, diabete di tipo 2, sclerosi laterale amiotrofica e malattie infiammatorie intestinali [53]. Uno di questi esempi è il gene SLIT3; questo gene sembra svolgere un ruolo nell’infiammazione indotta dai prodotti microbici e, in uno studio di associazione sull’intero genoma, sono state trovate varianti del gene associate al BMI, suggerendo una probabile relazione tra il gene, il suo prodotto molecolare, il microbioma umano e l’obesità [53]. Un aspetto polimorfico della genetica umana associato alla predisposizione alle malattie autoimmuni è l’antigene leucocitario umano (HLA), che sono proteine della superficie cellulare codificate da un gruppo di geni. È stato dimostrato che la variazione nella struttura HLA e nella genetica sottostante è correlata a cambiamenti distinti nel microbiota intestinale [54]. Ad esempio, la relazione tra la variante HLA-B27 e la condizione infiammatoria spondilite anchilosante è stata ben documentata in letteratura [55]. Uno studio che ha esaminato individui con questo particolare genotipo ha scoperto che esiste un profilo microbico intestinale distinto associato a HLA-B27, suggerendo che la spondilite anchilosante può essere guidata in parte da una predisposizione genetica a specifici processi immunologici, mediati dal microbiota intestinale [56]. Va inoltre notato che i risultati esistenti portano all’idea che la composizione del microbiota intestinale umano sia influenzata principalmente da fattori non genetici [57]. Tuttavia, quest’area di studio è ancora agli inizi e sono in corso ulteriori studi su coorti più ampie per comprendere meglio come il microbiota intestinale e il genoma umano siano correlati
4.5. Uso di antibiotici
Quando esposto agli antibiotici, il microbiota ospite può subire rapide alterazioni nella sua struttura, a seconda del tipo e della regolarità dell’uso. Un risultato comune è uno stato noto come disbiosi del microbiota intestinale, in cui si verifica uno squilibrio all’interno della microflora, che ne compromette di conseguenza il funzionamento [58]. Anche altri fattori, tra cui la dieta, le infezioni e i disturbi esistenti, possono causare la disbiosi. Un individuo affetto da disbiosi dovrà affrontare un rischio maggiore di una serie di morbilità, vale a dire di infezioni, poiché un microbiota sano ed equilibrato funge da ostacolo a potenziali ceppi patogeni, competendo per le risorse e prevenendo la crescita di microbi invasori [59]. Altri esiti associati alla disbiosi riguardano il sistema immunitario e la deregolamentazione metabolica. I risultati di un ampio studio trasversale internazionale su 74.946 individui esemplificano gli effetti della disbiosi indotta da antibiotici; è stato riscontrato che l’uso di antibiotici entro il primo anno di vita nei soggetti maschi ha contribuito alla disregolazione metabolica e quindi ad un aumento del BMI nelle fasi successive dell’infanzia, ma non nelle femmine [60]
5. Ruolo del microbiota intestinale nell’immunità e nell’infiammazione
I microbi possiedono una varietà di funzioni che influenzano la loro capacità di crescere e colonizzare, determinando al tempo stesso effetti a valle per l’ospite che possono essere benefici o meno [61]. Gli esseri umani non sono in grado di digerire alcuni componenti delle fibre alimentari a causa della mancanza degli enzimi necessari per scomporre e sfruttare l’energia di questi carboidrati [62]. Alcune specie di microbi producono enzimi specifici che consentono la fermentazione dei nutrienti in forme assorbibili, compresa quella dei carboidrati indigeribili in acidi grassi a catena corta (SCFA) [62,63]. Questi SCFA possono avere effetti antinfiammatori e immunomodulatori [63]. Gli SCFA rappresentano solo una piccola parte del quadro più ampio poiché, oltre agli enzimi e ad altri metaboliti prodotti, anche i componenti dei batteri stessi, inclusi lipopolisaccaridi, carboidrati delle capsule cellulari e altre endotossine, possono essere rilasciati e provocare effetti secondari sull’ospite. Questi effetti includono il mantenimento dell’epitelio intestinale (e quindi l’integrità della parete intestinale), la produzione di vitamine e le interazioni con diverse molecole e cellule chiave di segnalazione del sistema immunitario, attivando e inibendo risposte specifiche [1]. Oltre al metabolismo dei nutrienti, i microrganismi intestinali influenzano aspetti della farmacocinetica poiché svolgono il metabolismo dei farmaci [64]. Forniscono una difesa naturale contro le specie patogene attraverso la competizione e il mantenimento della mucosa. È attraverso il loro contatto con il sistema immunitario che i microrganismi che occupano l’intestino possono provocare o prevenire l’infiammazione. Possono essere associati a meccanismi antinfiammatori, stimolando le cellule regolatrici del sistema immunitario a inibire l’infiammazione [65]. D’altra parte, poiché i batteri regolano la permeabilità dell’intestino, alcune specie possono favorire un “intestino permeabile”, in cui i metaboliti associati ai microbi lasciano l’intestino ed entrano nel flusso sanguigno. In risposta, il corpo produce citochine e altri mediatori, lanciando di fatto una risposta infiammatoria [66]. Allo stesso modo, le cellule all’interno del tessuto epiteliale dell’intestino forniscono metaboliti batterici alle cellule immunitarie, promuovendo l’infiammazione sia su scala locale che sistemica. La persistenza di questa condizione può portare a un’infiammazione subacuta o cronica, che può successivamente portare allo sviluppo di malattie come malattie infiammatorie intestinali, diabete o malattie cardiovascolari [65].
6. Meccanismi proposti e relazioni tra il microbiota intestinale e i marcatori infiammatori
6.1. Lipopolisaccaridi
I lipopolisaccaridi (LPS), noti anche come endotossina, costituiscono il componente chiave della parete cellulare dei batteri Gram-negativi. Livelli aumentati di LPS sono osservati nell’obesità e in altri disturbi metabolici, nonché nell’infiammazione del tessuto adiposo e nella disfunzione delle cellule beta pancreatiche [23,67-69]. In condizioni normali, la barriera intestinale, compresi gli strati epiteliali e mucosi intestinali, riduce al minimo il movimento di LPS dall’intestino alla circolazione sistemica [70]. La rottura di questa barriera da parte di fattori quali la dieta o batteri patogeni può portare alla dislocazione e al movimento dell’LPS tra le giunzioni della barriera intestinale nella circolazione [70]. Questa permeabilità e permeabilità disregolata dell’intestino significa che i macrofagi possono infiltrarsi nella regione, produrre e attivare citochine infiammatorie, portando all’infiammazione locale [70]. Inoltre, l’LPS si lega al recettore toll-like 4 (TLR-4) presente sulle cellule immunitarie e, così facendo, può attivare cascate proinfiammatorie sia locali nell’intestino che in siti distanti [67]. In uno studio di Cani et al. [71], è stato riscontrato che i topi alimentati con una dieta ricca di grassi avevano un’elevata quantità di LPS circolante nel flusso sanguigno, mostrando endotossiemia, tuttavia quando venivano somministrati antibiotici, questo livello elevato di LPS non è stato riscontrato. Ciò dimostra che il microbiota intestinale indotto da diete ad alto contenuto di grassi rilascia LPS e, se preso di mira dagli antibiotici, gli effetti a valle dell’LPS verrebbero prevenuti. In questo caso si presume che gli antibiotici eliminino la maggior parte del microbiota, compresi i batteri che secernono LPS in sedi diverse dal tratto gastrointestinale. Dopo aver iniettato LPS a partecipanti umani sani, Mehta et al. [72] hanno riscontrato un aumento della resistenza all’insulina poiché i recettori dell’insulina nel tessuto adiposo venivano soppressi, sebbene la funzione delle cellule beta pancreatiche non fosse compromessa. Inoltre, uno studio di Tian et al. [73] hanno riferito che la terapia probiotica con Lactobacillus paracasei ha ridotto e invertito gli effetti della patologia associata a LPS nei roditori, riducendo in particolare i meccanismi associati al diabete di tipo 2 come la disfunzione delle cellule beta. Tuttavia, vale la pena notare che non tutti i membri del genere Lactobacillus hanno proprietà antidiabetiche, poiché in uno studio sull’uomo è stato riscontrato che il Lactobacillus gasseri era elevato nei soggetti con diabete di tipo 2 [74].
6.2. Acidi grassi a catena corta
Come affermato sopra, i batteri intestinali possiedono la capacità di metabolizzare i carboidrati complessi, altrimenti non digeriti dall’ospite, in SCFA. Gli SCFA svolgono un ruolo fondamentale nell’interazione tra la dieta, il microbiota intestinale e l’attivazione o l’inibizione a valle delle cascate infiammatorie. Inoltre, contribuiscono al controllo omeostatico dell’energia e alla regolazione dell’appetito attraverso i loro effetti sulle vie metaboliche [75]. A seconda del tipo e della concentrazione di SCFA, i loro effetti sull’infiammazione differiscono e i livelli di SCFA possono variare nei fenotipi obesi e magri [76]. In molti studi sugli animali, il butirrato SCFA è stato associato a una varietà di ruoli che si oppongono all’insorgenza di disordini metabolici [40]. Attraverso interazioni epigenetiche, il butirrato promuove la lipolisi e il funzionamento mitocondriale negli adipociti, consentendo così un maggiore dispendio energetico e prevenendo l’insorgenza o il mantenimento dell’obesità [77,78]. Il butirrato è un metabolita antinfiammatorio noto per inibire le vie che portano alla produzione di citochine proinfiammatorie [79,80]. In uno studio clinico su 13 pazienti con malattia di Crohn, è stato riscontrato che la somministrazione orale di butirrato allevia l’infiammazione in nove pazienti [81]. Inoltre, il butirrato riduce al minimo il rischio di sviluppo di resistenza all’insulina poiché migliora la segnalazione dell’insulina [82]. È stato anche dimostrato che il butirrato minimizza la traslocazione dell’LPS nell’intestino, riducendo così gli effetti associati all’LPS [40]. Faecalibacterium prausnitzii è stato identificato come un batterio produttore di butirrato con una relazione inversa con diversi marcatori proinfiammatori [83]. Negli individui obesi, l’abbondanza di F. prausnitzii è ridotta rispetto agli individui con peso corporeo sano [84]
6.3. Acidi biliari
Gli acidi biliari hanno una serie di ruoli nel corpo, dal consentire l’emulsione dei lipidi per consentirne l’assorbimento da parte dell’organismo, al funzionare come ligandi di segnalazione [67]. La conversione degli acidi biliari primari in acidi biliari secondari viene effettuata dai batteri intestinali. I cambiamenti nel microbiota intestinale influenzano i tipi di acidi biliari secondari che vengono sintetizzati, che a loro volta possono influenzare la secrezione degli ormoni dell’appetito dall’intestino, con conseguenti diverse inclinazioni dell’appetito [89]. Di particolare rilevanza per questa revisione è che gli acidi biliari, attraverso l’attivazione della via di segnalazione del recettore X del farnesoide (FXR) negli enterociti e negli adipociti, causano infiammazione [90]. Parseus et al. [20] hanno scoperto che i topi privi di FXR funzionali non accumulavano tessuto adiposo allo stesso modo dei topi con il recettore, suggerendo che il microbiota intestinale può favorire l’insorgenza dell’obesità attraverso la formazione di acidi biliari secondari.
6.4. Proteina C-reattiva
La proteina C-reattiva (CRP) è un reagente di fase acuta associato a malattie cardiovascolari, diabete di tipo 2 e obesità [21]. Quando i macrofagi e le cellule T secernono interleuchina (IL)-6, questa molecola viene successivamente rilasciata ad alti livelli nella circolazione [91]. In uno studio condotto da Xu e Song [21], la proporzione di Akkermansia muciniphila è diminuita nei topi obesi con elevati livelli plasmatici di CRP. Tuttavia, ciò non spiega se la CRP modula il microbiota intestinale o se i microrganismi intestinali contribuiscono al suo aumento. L’abbondanza di membri del genere Phascolarctobacterium è stata associata a livelli più bassi di CRP [92]. Questa relazione potrebbe potenzialmente chiarire perché una diminuzione della proporzione di questo genere è associata all’infiammazione del colon [93]: i Phascolarctobacterium sono produttori di propionato, un SCFA che inibisce le cascate proinfiammatorie sopprimendo l’attività del fattore nucleare regolatore proinfiammatorio kappa- B (NFκB) (vedere Sezione 6.5) [94,95]. Allo stesso modo, l’abbondanza di Faecalibacterium è inversamente correlata ai livelli di CRP [81,96]. Pertanto, la PCR è un marcatore infiammatorio a valle che può essere sottoregolato attraverso gli effetti dei prodotti metabolici antiinfiammatori di specifici microbi intestinali. La valutazione dei dati basali sul siero e sul microbiota di soggetti sani con BMI superiore a 25 ha mostrato che quelli con livelli di CRP più elevati avevano un’abbondanza significativamente inferiore di batteri dei generi Lactobacillus e Bifidobacterium, ma una maggiore abbondanza di Escherichia e Bacteroides [97].
6.5. Citochine
Le citochine segnalano molecole secrete dalle cellule immunitarie che influenzano numerosi processi all’interno del corpo, inclusa l’immunomodulazione [98]. Molti fattori di trascrizione regolano la produzione di citochine, tuttavia, il focus di questa recensione sarà su NFκB, un regolatore ritenuto prototipo e coinvolto nell’attivazione di vari geni correlati all’infiammazione [99]. Le citochine sono generalmente classificate come proinfiammatorie o antiinfiammatorie nei loro effetti a valle, sebbene questa classificazione binaria sia semplicistica e non tenga conto del fatto che specifiche citochine possono svolgere ruoli opposti in più processi e sono dipendenti dal contesto [100] . Una descrizione dettagliata delle prove relative a tutte le citochine e al microbiota intestinale va oltre lo scopo di questa recensione. Nelle sezioni seguenti, presentiamo alcune delle correlazioni accertate tra il microbiota intestinale e il TNF alfa e l’interleuchina-6, le due citochine più comunemente studiate.
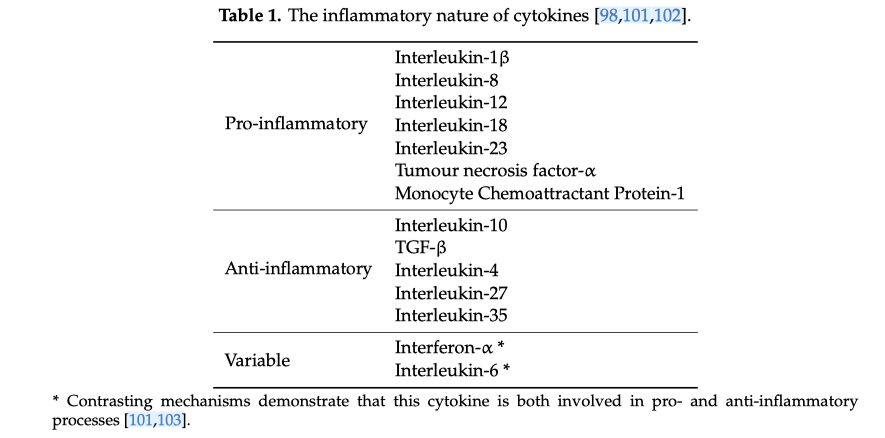
La tabella 1 evidenzia le tendenze generali di varie citochine, come riportato in studi precedenti.”
Note
1 – Metabolismo: Complesso di reazioni biochimiche di sintesi ( anabolismo ) e di degradazione ( catabolismo ), che si svolgono in ogni organismo vivente e che ne determinano l’accrescimento, il rinnovamento, il mantenimento. Altra definizione: Il metabolismo è l’insieme dei processi biochimici indispensabili per produrre energia a partire da ciò che introduciamo con l’alimentazione. Il nostro corpo riceve i nutrienti e li utilizza a seconda delle richieste dell’organismo.
Segue una revisione della recente letteratura sull’interazione tra microbiota intestinale, malattie metaboliche e infiammazione. Esploriamo le potenziali fisiopatologie sottostanti e i biomarcatori intermedi associati ai batteri intestinali e alle malattie infiammatorie. Infine, vengono discussi i limiti degli studi sul microbioma, con raccomandazioni per le future direzioni di ricerca.
2 – I polisaccaridi costituiscono una classe di composti chimici organici appartenente alla classe più ampia dei glucidi. Rispetto agli altri glucidi, sono caratterizzati da un gran numero di unità ripetitive, legate insieme per formare molecole grandi e complesse.
3 – Il lipopolisaccaride è uno dei componenti dello strato esterno della parete cellulare dei batteri Gram-negativi. Si trova nel foglietto esterno della membrana esterna di questa classe di batteri, mentre il foglietto interno è costituito da fosfolipidi. Si tratta di una grande molecola costituita da una porzione lipidica e una polisaccaridica in grado di suscitare forti risposte immunitarie negli animali.
4 – I batteri Gram-positivi vengono classificati in questo modo per il colore che assumono in seguito all’applicazione di un processo chimico denominato colorazione di Gram. Quando viene applicato questo processo, i batteri Gram-positivi assumono una colorazione blu. (Altri batteri assumono una colorazione rossa.”
The Gut Microbiota and Inflammation: An Overview. Zahraa Al Bander, Marloes Dekker Niter t et al.
Received: 10 September 2020; Accepted: 15 October 2020; Published: 19 October 2020
Internation Journal of Environmental Research and Public Health.
Back
