Glutine: aminoacidi, digestione, peptidi tossici e immunogenici
Gliadina e Glutenina
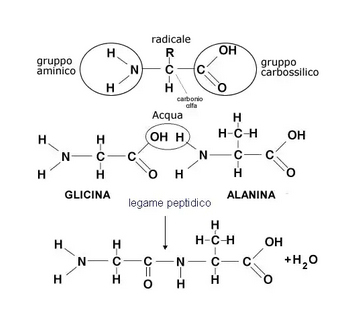
Sono le proteine del grano (la gliadina, solubile in alcol e la glutenina, insolubile in alcol.) e sono composte da catene di aminoacidi (1). La gliadina è costituita dall’unione di circa 100-200 amminoacidi (principale responsabile della celiachia), e la glutenina, costituita dalla combinazione di circa 2.000-20.000 amminoacidi. Il legame covalente che unisce due amminoacidi prende anche il nome in biochimica di “legame peptidico”. Una catena di più amminoacidi legati attraverso legami peptidici prende il nome generico di peptide o polipeptide o di oligopeptide se il numero di amminoacidi coinvolti è limitato; uno o più polipeptidi, a volte accompagnati da altre strutture ausiliarie o ioni dette cofattori o gruppi prostetici, costituiscono una proteina. Gli aminoacidi (o amminoacidi) sono l’unità strutturale primaria delle proteine. Possiamo quindi immaginare gli aminoacidi come mattoncini che, uniti da un collante chiamato legame peptidico, formano una lunga sequenza che dà origine ad una proteina.
Le proteine dei cereali solubili in alcol sono denominate: prolammine.
La prolamina del grano è la gliadina, dell’orzo l’ordeina, della segale la secalina, dell’avena l’avenina. I diversi tipi di prolamine contengono diversi aminoacidi e quanto più alto è il contenuto di prolina e glutamina (che sono alcuni degli aminoacidi che la compongo) tanto più quella prolamina, e quindi i peptidi di quel cereale saranno tossici (2) per il paziente affetto da malattia celiachia. I livelli più elevati di prolina e glutamina sono nel grano, orzo e segale. Anche le glutenine hanno alcune sequenze tossiche per i celiaci ma risultano essere molto meno attive nel sollecitare la risposta avversa del sistema umanitario dell’uomo.
Digestione della gliadina e glutenina
All’interno dello stomaco e del duodeno i legami che uniscono gli aminoacidi e gli oligopeptidi vengono digeriti attraverso l’azione di enzimi dedicati. Digerire significa ridurre gli oligopeptidi che costituiscono le due proteine (gliadina e glutenina) in frammenti più piccoli possibili. L’intestino tenue infatti è in grado di assorbire solo i singoli aminoacidi o frazioni con pochissimi aminoacidi.
La digestione della gliadina e della glutenina è legata alla lunghezza dei polipeptidi che le compongono, alla forza dei legami esistenti tra gli aminoacidi e tra i polipeptidi, alla sequenza/natura dei singoli aminoacidi.
Le proteine sono molecole resistenti alla digestione, così dobbiamo usare molti enzimi per ridurle in pezzi sempre più piccoli. La digestione delle proteine comincia nello stomaco, dove l’acido cloridrico crea l’ambiente adatto per l’enzima pepsina che esegue i primi tagli. Il grosso del lavoro comincia però più avanti, nell’intestino. Il pancreas produce molti enzimi proteolitici, il più importante dei quali è la tripsina, che riduce le catene proteiche in frammenti composti da un numero ridotto di amminoacidi. Poi, altri enzimi, sulla superficie delle cellule intestinali e all’interno delle cellule, operano ulteriore riduzione in frammenti piccolissimi o/e singoli aminoacidi che vengono assorbiti a partire dal duodeno per tutto il digiuno e l’ileo (le tre sezioni dell’intestino tenue) attraverso i villi intestinali per essere, poi assimilati per la sintesi di nuove proteine e non solo. Dopo essere stati assorbiti raggiungeranno il fegato dove possono:
a) essere utilizzati come tali per svolgere funzioni particolari (intervengono nelle risposta immunitaria, nella sintesi di ormoni e vitamine, nella trasmissione degli impulsi nervosi, nella produzione di energia e come catalizzatori in moltissimi processi metabolici)
b) partecipare alla sintesi proteica, un processo inverso a quello digestivo che ha lo scopo di fornire all’organismo i materiali per la crescita, il mantenimento e la ricostruzione delle strutture cellulari
c) se presenti in eccesso vengono utilizzati a scopi energetic i (gluconeogenesi) o convertiti in grasso di deposito.
Digestione parziale della gliadina e glutenina
Gliadina e glutenina non sono assimilabili così come sono (i peptidi che le compongono sono composte da moltissimi aminoacidi che formano lunghe catene) dall’intestino; l’idrolisi (spezzettamento) dei peptidi in singoli aminoacidi o frammenti piccolissimi (meno di 9 aminoacidi) è, dunque, fondamentale per poter attraversale l’epitelio intestinale; le frazioni più grandi, in generale, vengono eliminate con le feci. Altro fattore che influenza la digeribilità di queste proteine è costituita dalla tipologia degli aminoacidi costituenti: l’alto contenuto di prolina e glutamina rende queste proteine resistenti alla completa digestione nell’intestino tenue. “Prolamins (gliadins and glutenins) have a high content of proline (15%) and glutamine (35%) and, depending on the cereal, they have been termed secalin for rye, hordein for barley, avenin for oats, and gliadin for wheat. The high concentration of these amino acids, especially proline, limits proteolysis by gastrointestinal enzymes, preventing the complete degradation by human gastric and pancreatic enzymes. Microbial Proteases in Baked Goods: Modification of Gluten and Effects on Immunogenicity and
Product Quality . Nina G. Heredia-Sandoval , Maribel Y. Valencia-Tapia , Ana M. Calderón de la Barca and Alma R. Islas-Rubio . Received: 1 May 2016; Accepted: 27 August 2016; Published: 30 August 2016.”
Tollerabilità della gliadina e glutenina
In alcune persone alcuni specifici frammenti provenienti principalmente dalle α-gliadine e secondariamente dalle HMW-GS innescano la celiachia (Gilissen et al., 2014). Questi frammenti, sono peptidi costituiti da una sequenza di nove amminoacidi che provengono dalle proteine ricche in prolina e glutammina (prolamine), che sono resistenti alla digestione (Bethune and Khosla, 2008). Queste frazioni sono, generalmente, anche le più resistenti alla digestione gastro-intestinale. Pertanto, è stato ipotizzato che le gliadine pur difficilmente idrolizzabili dagli enzimi gastro-enterici, rimangano immunologicamente inattive nella maggior parte delle persone.
“Alimentary protein digestion followed by amino acid and peptide absorption in the small intestinal epithelium is considered an efficient process. Nevertheless, unabsorbed dietary proteins enter the human large intestine as a complex mixture of protein and peptides.53,63 The incomplete assimilation of some dietary proteins in the small intestine has been previously demonstrated, even with proteins that are known to be easily digested (e.g., egg protein).64,65 The high proline content of wheat gluten and related proteins renders these proteins resistant to complete digestion in the small intestine. As a result, many high molecular weight gluten oligopeptides arrive in the lower gastrointestinal tract.66 While gluten peptides pass through the large intestine, proteolytic bacteria could participate in the hydrolysis of these peptides. 81Gluten Metabolism in Humans. Alberto Caminero, … Javier Casqueiro, in Wheat and Rice in Disease Prevention and Health, 2014”
Il caso del peptide 33 mer
Tutti i grani/farri contengono frazioni (tossiche) che attivano la reazione del sistema immunitario umano in alcuni individui provocando la celiachia (stime: l’1-2% della popolazione) in altri l’intolleranza al glutine non celiaca (stime: il 5-10% della popolazione). La quantità e qualità di queste frazioni è molto varia è va, dunque, stimata per ogni varietà. Tra tutte le frazioni tossiche –come sopra detto- una in particolare è stata individuata come la più importante: il 33 mer dell’α-gliadina.
“The α-gliadin 33-mer is one of the digestion-resistant gluten peptides that is highly reactive to isolated celiac T cells and is the main immunodominant toxic peptide in celiac patients. It is located in the N-terminal repetitive region of α-gliadin and contains six overlapping copies of three different DQ2-restricted epitopes (Figure 6) [86]. Using RNA-amplicon sequencing (NGS) technology it was shown that α-gliadins can be separated into six types and only one type contains all the immunogenic peptides and epitopes, whereas the other five types do not contain all the epitopes disabling 33-mer peptide formation [30]. Thus, distinct types of α-gliadins differ mainly in the number of repeat blocks consisting in interspersed motifs PFPPQQ and PYPQPQ. Properties of Gluten Intolerance: Gluten Structure, Evolution, Pathogenicity and Detoxi=ication Capabilities. Anastasia V. Balakireva and Andrey A. Zamyatnin Jr. Nutrients: Received: 28 August 2016; Accepted: 11 October 2016; Published: 18 October 2016.”
Anche il peptide 33 mer è presente in tutte le farine di grano tenero e di farro spelta con diversi livelli di quantità (da 91–603 μg/g farina). Da sottolineare che nel il grano monococco, dicocco e grano duro il 33 mer è assente in quanto codificato nel genoma DD non presente nei citati grani.
“Coeliac disease (CD) is triggered by the ingestion of gluten proteins from wheat, rye, and barley. The 33-mer peptide from α2-gliadin has frequently been described as the most important CD-immunogenic sequence within gluten. However, from more than 890 published amino acid sequences of α-gliadins, only 19 sequences contain the 33-mer. In order to make a precise assessment of the importance of the 33-mer, it is necessary to elucidate which wheat species and cultivars contain the peptide and at which concentrations. This paper presents the development of a stable isotope dilution assay followed by liquid chromatography tandem mass spectrometry to quantitate the 33-mer in `lours of 23 hexaploid modern and 15 old common (bread) wheat as well as two spelt cultivars. All Flours contained the 33-mer peptide at levels ranging from 91–603 μg/g Flour. In contrast, the 33- mer was absent (<limit of detection) from tetra and diploid species (durum wheat, emmer, einkorn), most likely because of the absence of the D-genome, which encodes α2-gliadins. Due to the presence of the 33-mer in all common wheat and spelt flours analysed here, the special focus in the literature on this most immunodominant peptide seems to be justified……Omissis…..
“Quantitation of the immunodominant 33-mer pep&de from α-gliadin in wheat flours by liquid chromatography tandem mass spectrometry.
Kathrin Schalk , Christina Lang , Herbert Wieser , Peter Koehler & Katharina Anne Scherf. Scienti’ic Reports volume 7, Article number: 45092 (2017).”
Il caso del petide 13mer
ll peptide 13-mer LGQQQPFPPQQPY localizzato in posizione 31-43 di una α-gliadina nota come A-gliadina (Kasar-da et al., 1984) è molto attivo nell’indurre lesioni della mucosa intestinale e apoptosi dell’enterocita (Maiuri et al., 2003). Questo peptide, o la sua variante PGQQQPFPPQQPY in cui il residuo L (leucina) in posizione 31 è sostituito da P (prolina), è presente in molte sequenze di a-gliadina attualmente note (Kasarda et al., 1984; Kasarda e D’Ovidio, 1999; Arentz-Hansen et al., 2000). Esso non mostra un’attività immunogenica sulle cellule T, ma possiede la capacità delle prolamine di agglutinare le cellule indifferenziate K562, ostacola la guarigione dei pazienti con mucosa duodenale atrofica e attiva i meccanismi dell’immunità innata nella mucosa di pazienti celiaci a dieta senza glutine (De Ritis et al., 1988; Gianfrani et al., 2005).
(1) – Aminoacidi presenti nella gliadina e glutenina
(2) Ricerca traslazionale.
Identificato il repertorio dei peptidi tossici del glutine. Applicazioni terapeutiche per la malattia celiaca. Carmen Gianfrani commenta a Radio3 Scienza il recente studio apparso su Science Traslational Medicine. Questo studio, coordinato dal Dr Bob Anderson del Walter and Eliza Hall Institute of Medical Research di Melbourne, in collaborazione con le Università di Londra, Oxford e con il CNR di Avellino, ha individuato le sequenze del glutine responsabili della tossicità immunologica nella grande maggioranza dei pazienti celiaci analizzati. Attraverso una metodica innovativa, che utilizza un breve carico orale di alimenti contenenti glutine e l’analisi della riposta immune nel sangue periferico, sono stati analizzati circa 3000 peptidi diversi in una coorte di 226 pazienti celiaci adulti. Il dato più rilevante è che, sia che il paziente mangi frumento o segale o orzo, solo 3 sono le sequenze peptidiche responsabili della risposta infiammatoria. L’applicazione traslazionale di questo studio è rappresentata dalla formulazione di un vaccino terapeutico, al momento in fase 1b della sperimentazione clinica, che si basa su iniezioni sottocutanee ripetute di un unico peptide che include le 3 sequenze tossiche, allo scopo di indurre nei celiaci la tolleranza immunologica verso il cibo contenente glutine. (CNR 30 July 2010)
Approfondimento:
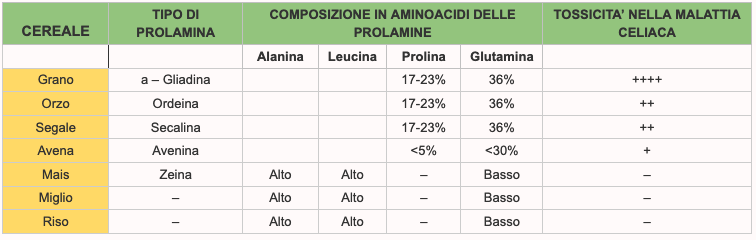
Classificazione degli aminoacidi. Nella sintesi proteica intervengono solo venti dei diversi aminoacidi esistenti in natura (attualmente oltre cinquecento). Dal punto di vista nutrizionale questi aminoacidi possono essere a loro volta divisi in due grandi gruppi: quello degli aminoacidi essenziali e quello degli aminoacidi non essenziali. Sono definiti essenziali quegli aminoacidi che l’organismo umano non riesce a sintetizzare in quantità sufficiente a far fronte ai propri bisogni. Per l’adulto sono otto e più precisamente: fenilalanina, isoleucina, lisina, leucina, metionina, treonina, tripofano e valina. Durante il periodo dell’accrescimento agli otto ricordati ne va aggiunto un nono, l’istidina, in considerazione del fatto che in questo periodo le richieste di tale aminoacido sono più elevate rispetto alla capacità di sintesi.
La funzione primaria degli aminoacidi è quella di intervenire nella sintesi proteica, necessaria per far fronte ai processi di rinnovamento cellulare dell’organismo. Oltre a questa funzione, detta “plastica”, gli aminoacidi hanno anche una modesta ma non trascurabile importanza nella produzione energetica (aminoacidi ramificati).
NOTE
1 – Dal punto di vista chimico l’aminoacido è un composto organico contenente un gruppo carbossilico (COOH) ed un gruppo aminico (NH2). Oltre a questi due gruppi ogni aminoacido si contraddistingue dagli altri per la presenza di un residuo (R) conosciuto anche con il nome di catena laterale dell’aminoacido.
2 – Sono considerati aminoacidi semiessenziali la cisteina e la tirosina, in quanto l’organismo li può sintetizzare a partire da metionina e fenilalanina. Sono definiti aminoacidi condizionatamente essenziali (arginina, glicina, glutammina, prolina e taurina) quegli aminoacidi che ricoprono un ruolo fondamentale nel mantenimento dell’omeostasi e delle funzioni dell’organismo in determinate situazioni fisiologiche. In alcune condizioni patologiche questi aminoacidi possono non essere sintetizzati a velocità sufficiente per far fronte ai reali bisogni dell’organismo. L’arginina sta assumendo notevole importanza, come precursore dell’ossido nitrico, per le tante funzioni che quest’ultimo espleta nell’attività cellulare, nella trasduzione dei segnali biologici e nella difesa immunitaria.
3 – CONTENUTO IN AMINOACIDI ESSENZIALI: si possono definire complete quelle proteine che contengono tutti gli AA essenziali in quantità e in rapporti equilibrati. In generale le proteine animali sono complete e quelle vegetali sono incomplete.
4 – AMINOACIDO LIMITANTE: di una proteina o di una miscela proteica è l’aminoacido essenziale carente o del tutto assente che limita l’utilizzo di tutti gli altri aminoacidi anche se presenti in eccesso rispetto ai bisogni. Come abbiamo visto nelle proteine di origine vegetale questo aminoacido non è in genere sufficiente a garantire il fabbisogno e dev’essere introdotto tramite l’abbinamento con altri cibi.
5 – INDICE CHIMICO: è dato dal rapporto tra la quantità di un dato aminoacido in un grammo della proteina in esame e la quantità dello stesso aminoacido in un grammo della proteina di riferimento biologica (dell’uovo). Più è alto questo indice e maggiore sarà la percentuale di aminoacidi essenziali.
6 – AMINOACIDI RAMIFICATI: o BCAA sono tre aminoacidi essenziali (Valina, Isoleucina e Leucina) che in particolari condizioni, come l’impegno fisico intenso, vengono utilizzati come substrato energetico ausiliario di grassi e carboidrati.
7 – Alcuni aminoacidi sono inoltre precursori di composti che svolgono importanti funzioni biologiche. Dal triptofano si ottengono la niacina (vitamina PP), la serotonina (neurotrasmettitore) e la melatonina (regolatore dei ritmi circadiani ciclo sonno/veglia).
Dagli aminoacidi solforati (metionina e cisteina) si ottiene il glutatione, importante antiossidante utile per combatterei radicali liberi e la cheratina, proteina essenziale per la salute di peli, capelli ed unghie. Oltre a quelli coinvolti nella sintesi delle proteine, molti altri aminoacidi svolgono funzioni molto importanti. Tra questi i più conosciuti in campo sportivo sono la creatina (utile per incrementare capacità e potenza anaerobica alattacida e lattacida) e la carnitina che facilita il trasporto dei lipidi all’interno del mitocondrio).
Back
