Biochimica, reologia e microbiologia della fermentazione e della matrice amido-proteica
Il presente testo analizza i fondamenti biochimici, reologici e microbiologici alla base della produzione di pane e pizza. Vengono esaminati il ruolo delle proteine del glutine (gliadine e glutenine), i sistemi fermentativi (lievito di birra e pasta acida), le variabili di dosaggio e tempo e le metodiche di impasto diretto e indiretto. L’approccio adottato è di tipo tecnologico-funzionale, con particolare attenzione alle implicazioni strutturali, aromatiche, digestive e di conservabilità del prodotto finito.
Capitolo I – Architettura proteica dell’impasto: gliadine, glutenine e maglia glutinica
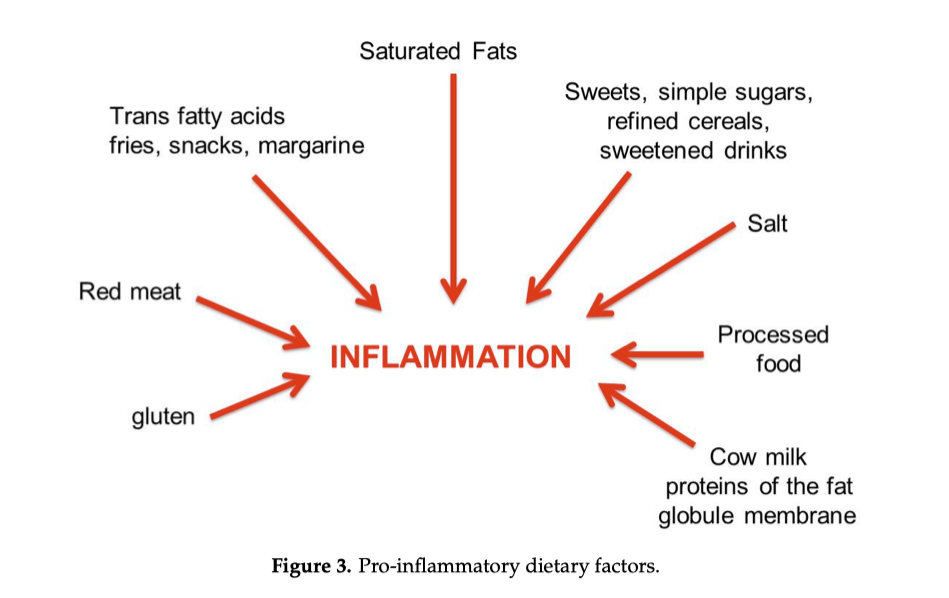
Quando impastiamo farina e acqua, non stiamo solo mescolando ingredienti: stiamo attivando un sistema proteico complesso che determina struttura, consistenza e risultato finale. Alla base di tutto c’è il glutine, una rete tridimensionale che nasce dall’interazione tra due famiglie di proteine del grano: gliadine e glutenine. Capire il loro equilibrio significa comprendere perché un impasto per pizza si stende facilmente mentre quello per pane deve sostenere una struttura alta e alveolata.
1️⃣ La maglia glutinica: un equilibrio dinamico
Il glutine non esiste “già formato” nella farina. Si crea quando:
Glutenina + Gliadina + Acqua + Impastamento = Maglia glutinica
L’acqua idrata le proteine, l’energia meccanica dell’impastamento le fa interagire, e si forma una rete elastica capace di intrappolare i gas della lievitazione. Ma le due proteine svolgono ruoli diversi e complementari.
2️⃣ Il ruolo delle glutenine: forza ed elasticità
|
Glutenine – Effetti strutturali |
|||
|
Le glutenine conferiscono |
Elasticità (capacità di tornare alla forma iniziale) |
Tenacità (resistenza alla deformazione) |
Struttura |
|
Un impasto ricco di glutenine |
È più resistente |
Trattiene meglio i gas |
Sviluppa volume in altezza |
|
Se sono eccessive |
Troppo tenace |
Difficile da stendere |
Effetto “molla” |
3️⃣ Il ruolo delle gliadine: estensibilità e viscosità
Le gliadine sono responsabili di:
-
Estensibilità (capacità di allungarsi senza strapparsi)
-
Malleabilità
-
Viscosità
Grazie alle gliadine, l’impasto:
-
Si stende facilmente
-
Non si lacera durante la lavorazione
-
Mantiene una buona lavorabilità
Se prevalgono troppo, però, l’impasto:
-
Diventa molle
-
Si “siede”
-
Fatica a mantenere la forma
4️⃣ Pizza: serve estensibilità
Nel caso della pizza, l’obiettivo è ottenere un disco sottile che:
-
Si stenda facilmente
-
Non si strappi
-
Non torni indietro durante la formatura
L’estensibilità è quindi fondamentale. Un impasto troppo ricco di glutenine sarebbe “gommoso” e difficile da aprire.
Per questo le farine per pizza (spesso di grano tenero) sono progettate per avere:
-
Un buon equilibrio tra forza ed estensibilità
-
Un rapporto P/L (tenacità/estensibilità) equilibrato o leggermente spostato verso l’estensibilità
Se l’impasto è troppo tenace, si può intervenire con:
-
Maggiore maturazione (riposo più lungo)
-
Aumento dell’idratazione
-
Scelta di una farina con P/L più basso
In sintesi: più estensibilità = stesura facile e buona alveolatura.
5️⃣ Pane: serve forza strutturale
Perché il pane ha bisogno di più glutenine?
Il pane ha un obiettivo diverso: svilupparsi in altezza e sostenere una struttura interna ricca di alveoli.
Qui entrano in gioco:
-
Elasticità
-
Tenuta strutturale
-
Capacità di trattenere i gas della fermentazione
Un impasto per pane necessita quindi di una maglia glutinica più robusta, con una componente maggiore di glutenine.
Se prevalgono troppo le gliadine:
-
L’impasto diventa debole
-
Si allarga invece di crescere
-
Il pane risulta basso e poco strutturato
In sintesi: più glutenine = più forza e sviluppo verticale.
6️⃣ L’equilibrio è la chiave
Il punto fondamentale non è “quale proteina è migliore”, ma il loro rapporto.
-
Troppa glutenina → impasto tenace, duro da stendere
-
Troppa gliadina → impasto molle e poco stabile
-
Equilibrio corretto → struttura elastica ed estensibile
La differenza tra pizza e pane sta proprio in questo bilanciamento:
|
Prodotto |
Caratteristica dominante |
Rapporto proteico |
|---|---|---|
|
Pizza |
Estensibilità |
Buona presenza di gliadine |
|
Pane |
Forza ed elasticità |
Maggiore componente di glutenine |
7️⃣ In conclusione
-
Pizza → più estensibilità (gliadine)
-
Pane → più forza ed elasticità (glutenine)
La qualità di un impasto non dipende solo dalla quantità di proteine, ma dalla loro interazione, dalla lavorazione, dall’idratazione e dai tempi di maturazione. Ogni volta che stendiamo una pizza o modelliamo un pane, stiamo lavorando con un delicato equilibrio molecolare: una vera architettura proteica che trasforma farina e acqua in una struttura viva, elastica ed estensibile.
Capitolo II – Fermentazione in panificazione e pizzeria professionale
Ruolo del lievito di birra e della pasta acida, quantità, tempo e metodiche di impasto
1. Introduzione
La fermentazione rappresenta il cuore biologico e tecnologico della panificazione e della pizzeria professionale. Non si limita alla produzione di gas per l’aumento di volume dell’impasto, ma determina in modo profondo:
-
Struttura meccanica
-
Estensibilità
-
Alveolatura
-
Profilo aromatico
-
Digeribilità
-
Conservabilità
Il professionista non gestisce semplicemente una “lievitazione”, ma un processo biochimico complesso in cui interagiscono:
-
Microrganismi
-
Enzimi endogeni della farina
-
Proteine del glutine
-
Amidi
-
Tempo
-
Temperatura
Questo capitolo analizza in modo sistematico il ruolo del lievito di birra e della pasta acida, l’influenza del dosaggio e del tempo fermentativo, e l’impatto delle metodiche (impasto diretto e indiretto con biga) sul prodotto finito.
2. Il ruolo del lievito di birra
2.1 Natura microbiologica
Il lievito di birra è costituito prevalentemente da Saccharomyces cerevisiae, microrganismo unicellulare capace di metabolizzare gli zuccheri semplici presenti nell’impasto.
La fermentazione alcolica produce:
-
Anidride carbonica (CO₂)
-
Etanolo
-
Metaboliti secondari (esteri, alcoli superiori, aldeidi)
La CO₂ viene trattenuta dalla maglia glutinica e genera l’aumento di volume.
2.2 Effetti tecnologici
Il lievito di birra:
-
Fornisce gas per lo sviluppo strutturale
-
Stimola l’attività enzimatica indirettamente
-
Influenza il ritmo fermentativo
-
Determina parte del profilo aromatico
Non modifica significativamente il pH dell’impasto (acidità limitata), pertanto l’effetto sulla struttura proteica è principalmente meccanico e fermentativo, non acidificante.
3. Il ruolo della pasta acida
3.1 Natura microbiologica
La pasta acida è un ecosistema composto da:
-
Lieviti selvaggi
-
Batteri lattici (omo- ed eterofermentanti)
Questi microrganismi producono:
-
CO₂
-
Acido lattico
-
Acido acetico
-
Enzimi proteolitici
-
Composti aromatici complessi
3.2 Effetti tecnologici
|
L’attività combinata di lieviti e batteri |
|
| L’attività combinata di lieviti e batteri determina | L’acidità controllata di lieviti e batteri influenza direttamente |
|
Acidificazione progressiva (riduzione del pH) |
Elasticità |
|
Modifica della struttura del glutine |
Estensibilità |
|
Attivazione di proteasi |
Conservabilità |
|
Migliore stabilità microbiologica |
Profondità aromatica |
4. Quantità e tempo: principi generali
4.1 Relazione tra dosaggio e velocità
La quantità di agente fermentante regola:
-
Velocità di produzione di CO₂
-
Intensità metabolica
-
Durata del processo
Principio fondamentale:
-
Più lievito → fermentazione rapida
-
Meno lievito → fermentazione lenta
Tuttavia, la velocità non coincide con la maturazione.
4.2 Il tempo come variabile chiave
Il tempo consente:
-
Degradazione enzimatica degli amidi (amilasi)
-
Parziale idrolisi proteica
-
Riorganizzazione della rete glutinica
-
Formazione di metaboliti aromatici
Una fermentazione breve può produrre volume, ma non necessariamente maturazione strutturale e biochimica.
5. Effetti sulla digeribilità
5.1 Definizione tecnica
Per digeribilità si intende:
-
Riduzione del carico fermentabile intestinale
-
Parziale predigestione di amidi e proteine
-
Migliore organizzazione strutturale della mollica
Non implica assenza di glutine, ma trasformazione biochimica più avanzata.
5.2 Lievito di birra
|
Dosaggio Lievito di Birra |
|
| Dosaggio alto + tempo breve | Dosaggio basso + tempo lungo |
|
Maturazione limitata |
Maggiore maturazione |
|
Minore attività enzimatica |
Migliore degradazione enzimatica |
|
Maggiore presenza di zuccheri residui |
Impasto biochimicamente evoluto |
|
Possibile sensazione di pesantezza |
Sensazione di maggiore leggerezza |
5.3 Pasta acida
La fermentazione con pasta acida determina:
-
Riduzione progressiva del pH (acidificazione controllata)
-
Incremento dell’attività proteolitica (enzimi endogeni + attività microbica)
-
Parziale idrolisi delle proteine del glutine
-
Maggiore degradazione degli zuccheri fermentabili
-
Modificazione delle proprietà reologiche della maglia glutinica
Effetti tecnologici e fisiologici misurabili
Le fermentazioni prolungate con pasta acida comportano:
-
Riduzione del contenuto di carboidrati fermentabili residui
-
Parziale predigestione proteica
-
Migliore organizzazione strutturale della mollica
-
Rallentamento della risposta glicemica rispetto a fermentazioni brevi
-
Maggiore stabilità microbiologica del prodotto
L’insieme di questi fattori può determinare:
-
Riduzione del carico fermentativo intestinale
-
Minore produzione di gas a livello intestinale rispetto a impasti a fermentazione rapida
La risposta fisiologica individuale può variare in funzione di condizioni personali, ma i meccanismi biochimici sopra descritti sono oggettivamente misurabili.
6. Effetti su pizza e pane
6.1 Pizza
|
Obiettivi strutturali |
||||
|
Obiettivi strutturali |
Elevata estensibilità |
Assenza di effetto “molla” |
Cornicione alveolato |
Scioglievolezza |
|
Strategia tipica |
Dosaggio molto basso di lievito |
Maturazione lunga (24–72 ore) |
Controllo della temperatura |
|
|
Risultati |
Maggiore estensibilità |
Aroma più complesso |
Minore sensazione di gonfiore |
|
6.2 Pane
|
Obiettivi strutturali |
||||
|
Obiettivi strutturali generali |
Sviluppo verticale |
Stabilità della mollica |
Conservabilità |
|
|
Obiettivi con lievito di birra |
Struttura regolare |
Aroma delicato |
||
|
Obiettivi con pasta acida |
Alveolatura irregolare |
Crosta spessa |
Aroma profondo |
Maggiore shelf life |