Studi primari (evidenze principali)
1. Effetti di co-fermentazione LAB + lievito sulla degradazione del glutine
Titolo: Effects of Co-Fermentation with Lactic Acid Bacteria and Yeast on Gliadin Degradation in Whole-Wheat Sourdough
Sintesi: Lo studio valuta come ceppi selezionati di Batteri Lattici (LAB) e lievito di birra (Saccharomyces cerevisiae) co-fermentino il glutine nella pasta madre integrale. La fermentazione combinata porta a una degradazione significativa delle frazioni di gliadina e glutenina, con riduzione del contenuto di glutine. Ceppi come Lactobacillus brevis e Pediococcus pentosaceus mostrano un’elevata attività proteolitica. (MDPI)
2. Riduzione dell’allergenicità del glutine in prodotti fermentati
Titolo: From gluten structure to immunogenicity: Investigating the effects of lactic acid bacteria and yeast co-fermentation on wheat allergenicity in steamed buns
Sintesi: La co-fermentazione LAB + lievito di birra induce depolimerizzazione delle macromolecole di glutine e riduce l’immunoreattività totale rispetto ai controlli non fermentati. Osservata diminuzione significativa di α/γ-gliadine e glutenine associate alla celiachia. (PubMed)
3. Peptidi immunogenici e sourdough
Titolo: A Case Study of the Response of Immunogenic Gluten Peptides to Sourdough Proteolysis
Sintesi: La fermentazione con pasta madre modifica la struttura del glutine e il profilo di rilascio dei peptidi immunogenici durante la digestione in vitro, senza necessariamente eliminarli completamente. Studio comparativo tra pane sourdough e pane a lievitazione rapida. (PubMed)
4. Bacillus spp. isolati da sourdough e idrolisi del glutine
Titolo: Gluten hydrolyzing activity of Bacillus spp isolated from sourdough
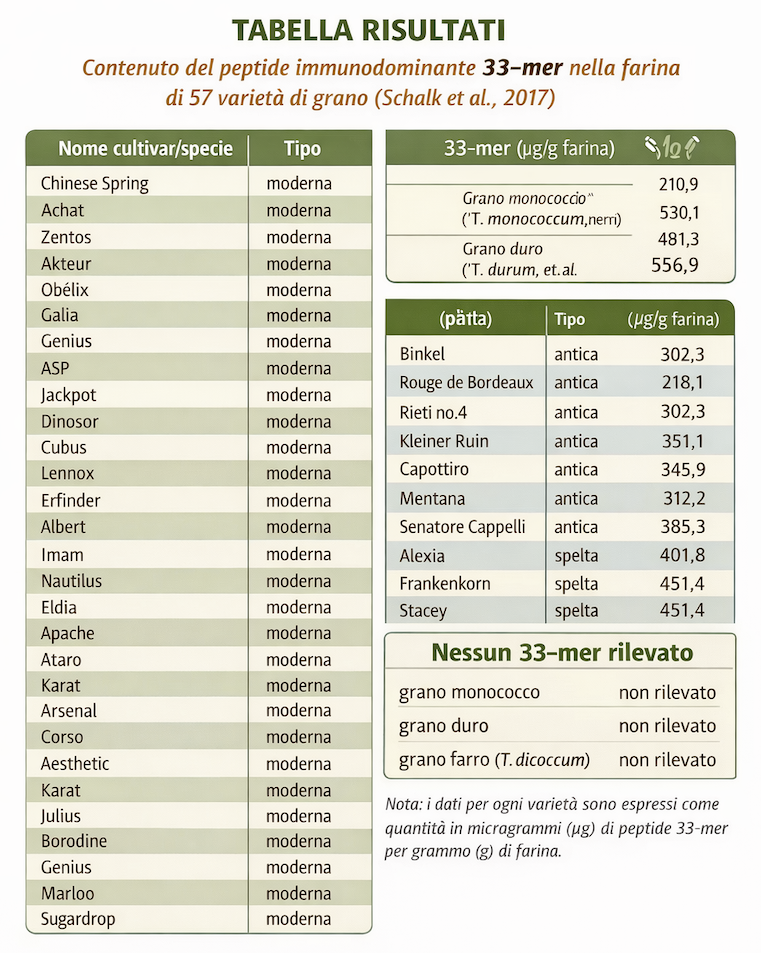
Sintesi: Ceppi di Bacillus isolati da pasta madre degradano il peptide immunogenico 33-mer e sequenze di gliadina, riducendo il glutine sotto 110 mg/kg. Potenziale applicazione in prodotti a glutine ridotto. (SpringerLink)
5. Studio clinico pilota su prodotti fermentati
Titolo: Gluten-free sourdough wheat baked goods appear safe for young celiac patients: a pilot study
Sintesi: Fermentazione con lactobacilli selezionati e proteasi fungine riduce il glutine sotto 10 ppm. Prodotti testati su bambini celiaci in remissione mostrano buona tollerabilità clinica. (PubMed)
6. Review recente sul ruolo della fermentazione (2025)
Titolo: Sourdough Fermentation and Gluten Reduction: A Biotechnological Approach for Gluten-Related Disorders
Sintesi: La fermentazione LAB contribuisce alla riduzione dei peptidi di glutine ma non è sufficiente da sola a eliminare tutte le sequenze immunogeniche. Processi combinati con proteasi esogene risultano più efficaci. (MDPI)
Approfondimenti (studi già citati, con maggior dettaglio)
A. Bacillus spp isolated from sourdough
DOI: 10.1186/s12934-020-01388-z
Approfondimento: Lo studio dimostra l’elevata attività proteolitica dei ceppi di Bacillus contro substrati di gliadina e il peptide 33-mer. L’idrolisi estensiva porta a livelli di glutine <110 mg/kg nel sourdough fermentato.
B. Label-free quantitative proteomics and sourdough fermentation
DOI: 10.1016/j.foodchem.2023.137037
Approfondimento: L’analisi proteomica identifica 85 proteine allergeniche modulate dalla fermentazione. Alcune combinazioni microbiche mostrano riduzione di gliadine contenenti sequenze immunogeniche, suggerendo un effetto selettivo della fermentazione sulla frazione proteica del grano.
C. Yeast–bacteria interactions and immunogenicity
DOI: 10.1016/j.ifset.2023.103281
Approfondimento: Le co-colture di lieviti (Saccharomyces, Torulaspora) con Pediococcus acidilactici mostrano maggiore depolimerizzazione del glutine e riduzione dell’immunogenicità rispetto alle fermentazioni con lievito singolo.
Conclusioni generali
-
La fermentazione con pasta madre può degradare parzialmente il glutine e ridurre specifici peptidi immunogenici.
-
La riduzione non equivale a eliminazione completa: senza proteasi esogene spesso rimane glutine residuo.
-
L’efficacia dipende fortemente dai ceppi microbici e dalle condizioni di fermentazione.
Cosa significa tutto questo per chi cerca prodotti gluten light?
I prodotti realizzati con pasta acida (sourdough) presentano, in media, caratteristiche tecnologiche e biochimiche superiori rispetto ai prodotti ottenuti con lievitazioni rapide, soprattutto quando si parla di tollerabilità e qualità complessiva.
In particolare:
-
Parziale degradazione del glutine: la fermentazione prolungata favorisce l’idrolisi di alcune frazioni di gliadina e glutenina, riducendo la complessità proteica rispetto a impasti non fermentati.
-
Profilo peptidico modificato: anche quando il glutine non viene eliminato, la sua struttura risulta diversa, con potenziale riduzione di specifici peptidi immunogenici.
-
Maggiore digeribilità percepita: molti consumatori non celiaci riferiscono una migliore tolleranza gastrointestinale rispetto a prodotti da forno industriali a lievitazione rapida.
-
Riduzione di altri fattori critici: la fermentazione con pasta madre contribuisce anche alla diminuzione dei FODMAP e di alcuni composti antinutrizionali.
⚠️ Nota importante: i prodotti gluten light non sono automaticamente sicuri per i celiaci. La fermentazione tradizionale migliora la qualità e la tollerabilità, ma solo processi controllati e validati possono portare a livelli di glutine compatibili con una dieta senza glutine.
Per chi non è celiaco ma cerca prodotti più digeribili, meno stressanti per l’intestino e basati su processi fermentativi naturali, la pasta acida rappresenta oggi una delle soluzioni più interessanti supportate dalla letteratura scientifica.
Nota importante (scientifica)
La degradazione del glutine è dovuta quasi interamente ai LAB (acidificazione + proteasi).
Il lievito:
-
contribuisce poco direttamente alla proteolisi
-
ma modula l’ambiente fermentativo (pH, zuccheri, tempi)
Quindi ha senso che lo studio li analizzi insieme, ma i LAB sono i veri protagonisti.