Riassunto delle principali caratteristiche del grano monococco che gli conferiscono grande potenzialità per essere utilizzato per la preparazione di prodotti da forno salati ma anche dolci per le persone che:
a – sono geneticamente predisposte per la celiachia (1) (2) (3) (4) (5),
b – debbono tenere sotto controllo l’indice glicemico (6),
c- sono sensibili al glutine non celiache, reintroducono il glutine dopo la sua esclusione (7),
d – hanno difficoltà con la digestione del glutine (8).
e – sono sensibili alle ATI -amylase trypsina inibitors-. (9)
Da sottolineare, anche, le elevate qualità nutrizionali del grano monococco (10) (11).
(1) ………..omissis. “Conclusions: Our data show that the monococcum lines Monlis and ID331 activate the CD T cell response and suggest that these lines are toxic for celiac patients. However, ID331 is likely to be less effective in inducing CD because of its inability to activate the innate immune pathways”. Immunogenicity of monococcum wheat in celiac patients. Carmen Gianfrani et altri. Am J Clin Nutr 2012;96:1339–45.
(2) ………omissis. “D’altra parte, tenuto conto che l’incidenza e la gravità della celiachia dipende dalla quantità e dalla nocività delle prolamine e che alcuni genotipi di grano monococco hanno una elevata qualità panificatoria accoppiata con assenza di citotossicità e ridotta immunogenicità, è atteso che l’uso delle farine di monococco nella dieta della popolazione generale, all’interno della quale si trova una elevata percentuale di individui predisposti geneticamente alla celiachia ma non ancora celiaci, possa contribuire a contenere la diffusione di questa forma di intolleranza alimentare. Ciò lascia pensare che il grano monococco, riportato recentemente in coltivazione in Italia dai ricercatori del Consiglio per la Ricerca e la sperimentazione in Agricoltura (CRA) di Roma e San Angelo Lodigiano, potrà svolgere un ruolo importante nella prevenzione della celiachia, sia direttamente sotto forma di pane e pasta sia indirettamente come specie modello per lo studio del ruolo dell’immunità innata nell’insorgenza della celiachia”. Le nuove frontiere delle tecnologie alimentari e la celiachia Norberto Pogna, Laura Gazza (2013).
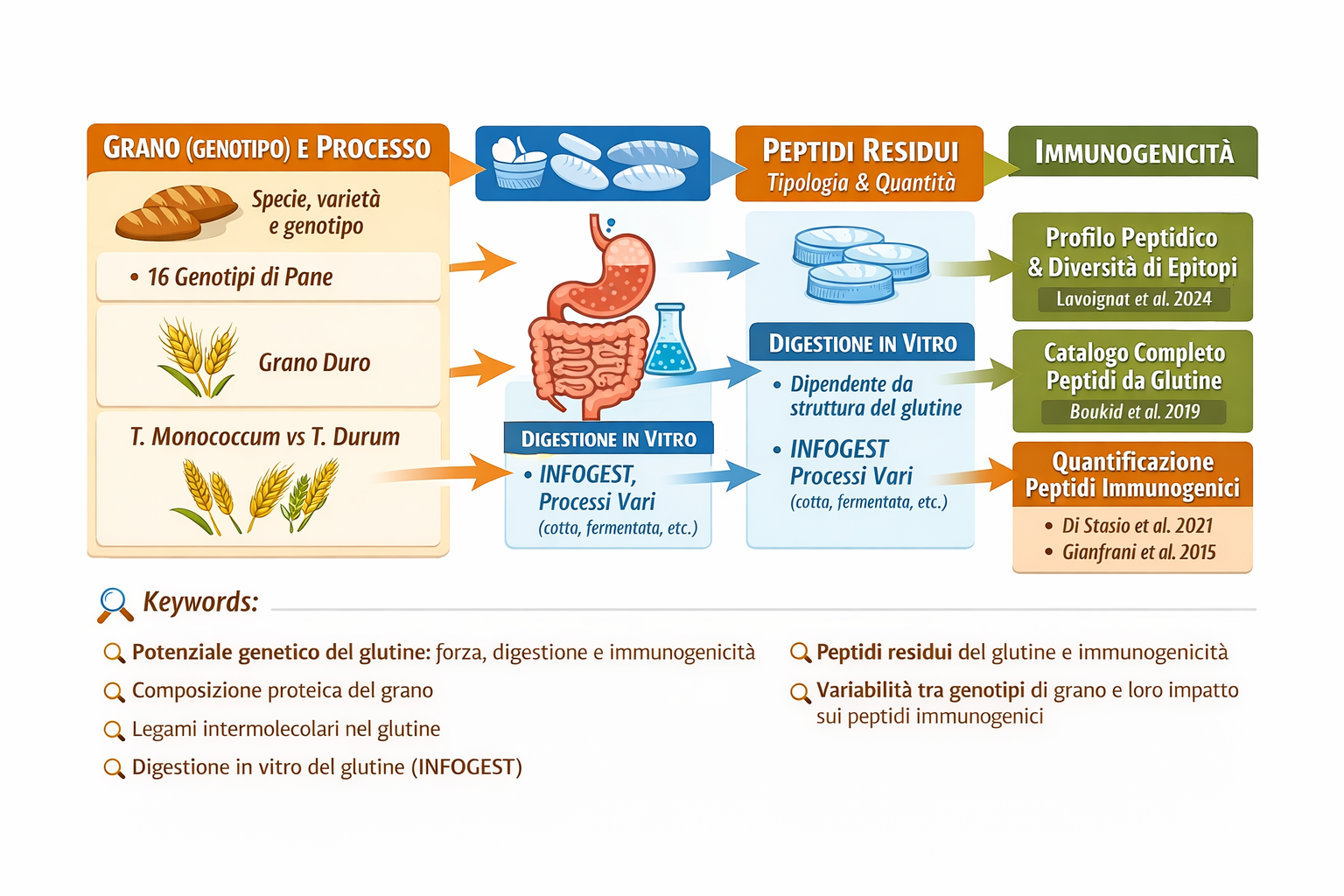
(3)-Extensive in vitro gastrointestinal digestion markedly reduces the immune-toxicity of Triticum monococcum wheat: Implication for celiac disease
Carmen Gianfrani, Alessandra Camarca, Giuseppe Mazzarella, Luigia Di Stasio, Nicola Giardullo, Pasquale Ferranti, Gianluca Picariello, Vera Rotondi Aufiero, Stefania Picascia, Riccardo Troncone, Norberto Pogna, Salvatore Auricchio
and Gianfranco Mamone. Mol. Nutr. Food Res. 2015, 00, 1–11
Scope: The ancient diploid Triticum monococcum is of special interest as a candidate low-toxic wheat species for celiac disease patients. Here, we investigated how an in vitro gastro-intestinal digestion, affected the immune toxic properties of gliadin from diploid compared to hexaploid wheat.
Method and results: Gliadins from Triticum monococcum, and Triticum aestivum cultivars were digested using either a partial proteolysis with pepsin-chymotrypsin, or an extensive degradation that used gastrointestinal enzymes including the brush border membrane enzymes. The immune stimulatory properties of the digested samples were investigated on T-cell lines and jejunal biopsies from celiac disease patients. The T-cell response profile to the Triticum mono coccum gliadin was comparable to that obtained with Triticum aestivum gliadin after the partial pepsin-chymotrypsin digestion. In contrast, the extensive gastrointestinal hydrolysis drastically reduced the immune stimulatory properties of Triticum monococcum gliadin. MS-based analy- sis showed that several Triticum monococcum peptides, including known T-cell epitopes, were degraded during the gastrointestinal treatment, whereas many of Triticum aestivum gliadin survived the gastrointestinal digestion.
Conclusion: he pattern of Triticum monococcum gliadin proteins is sufficiently different from those of common hexaploid wheat to determine a lower toxicity in celiac disease patients following in vitro simulation of human digestion.
(4) …….omissis. “Abstract. A growing interest in developing new strategies for preventing coeliac disease has motivated efforts to identify cereals with null or reduced toxicity. In the current study, we investigate the biological effects of ID331 Triticum monococcum gliadin-derived peptides in human Caco-2 intestinal epithelial cells. Triticum aestivum gliadin derived peptides were employed as a positive control. The effects on epithelial permeability, zonulin release, viability, and cytoskeleton reorganization were investigated. Our findings confirmed that ID331 gliadin did not enhance permeability and did not induce zonulin release, cytotoxicity or cytoskeleton reorganization of Caco-2 cell monolayers. We also demonstrated that ID331 ω-gliadin and its derived peptide ω(105–123) exerted a protective action, mitigating the injury of Triticum aestivum gliadin on cell viability and cytoskeleton reorganization. These results may represent a new opportunity for the future development of innovative strategies to reduce gluten toxicity in the diet of patients with gluten intolerance”. Protective effects of ID331 Triticum monococcum gliadin on in vitro models of the intestinal epithelium. Giuseppe Jacomino et altri 2016.
(5)………omissis. “Scientific research has several times supported and encouraged the use of grains with low toxicity in the prevention of celiac disease; in the research we are now presenting, some grains have been studied highlighting their profile regarding both the presence of peptides resistant to gastro-intestinal digestion and, among these, those containing the “toxic” fraction (table 3) “ ….omissis Even if none of them can be considered safe for CD patients, grain with reduced amount of major T-cell stimulatory epitopes may help in the prevention of CD, since previous studies demonstrated that the amount and duration to gluten exposure are strictly linked to the initiation of this pathology.” (A Comprehensive Peptidomic Approach to Characterize the Protein Profile of Selected Durum Wheat Genotypes: Implication for Coeliac Disease and Wheat Allergy. Rosa Pilolli , Agata Gadaleta, Luigia Di Stasio , Antonella Lamonaca, Elisabetta De Angelis , Domenica Nigro , Maria De Angelis , Gianfranco Mamone and Linda Monac. Published: 1 October 2019).
(6) ….omissis. Non tutto l’amido è rapidamente idrolizzato durante la digestione, la frazione che resiste alla digestione e all’assorbimento nell’intestino tenue umano è definita “amido resistente” e ha effetti fisiologici comparabili a quelli della fibra alimentare. Il grano monoccoco però ha un basso contenuto (0,2%) in “amido resistente” se confrontato con il grano tenero(0,4- 0,8%) (Abdel-Aal et al. 2008).
(7) ….omissis. “Once the diagnosis of NCGS is reasonably reached, the management and follow-up of patients is completely obscure. A logical approach is to undertake a gluten-free dietary regimen for a limited period (e.g., six months), followed by the gradual reintroduction of gluten. During the gluten-free diet, the ingestion of prolamine peptide (gliadin)-derived from wheat, rye, barley, oats, bulgur, and hybrids of these cereal grains-should be avoided. Rice, corn, and potatoes have been the typical substitutes, but nowadays other different cereals and pseudocereals, such as amaranth, buckwheat, manioc, fonio, teff, millet, quinoa, and sorghum, can be used. After some period on a gluten-free diet, the reintroduction of gluten can start with cereals of low gluten content (e.g., oats). In addition, einkorn farro (Triticum monococcum) can be used, having no direct in vitro or ex vivo toxicity and low (7%) gluten content[41]”. (Non-celiac gluten sensitivity: Time for sifting the grain. Luca Elli, Leda Roncoroni, and Maria Teresa Bardella. Copyright ©The Author(s) 2015. Published by Baishideng Publishing Group Inc.
Read More